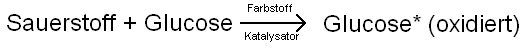Was ist Chemie?
Chemie ist eine Naturwissenschaft, die sich mit den Veränderungen und Interaktionen der Stoffe befasst. Es werden chemische Stoffe definiert, Eigenschaften von Veränderungen und Umwandlungen vorhergesagt und auf Grund der Struktur analysiert. Sehr wichtig für das Verständnis der Chemie ist das korrekte aufstellen von Reaktionsgleichungen. Anhand von ihnen kann man viele zentrale Prozesse der Chemie beschreiben und vervollständigen. Experimente waren und sind immer noch in der Chemie von grundlegender Bedeutung. Was man nicht berechnen oder vorhersehen kann, wird anhand von Experimenten nachgewiesen. Heutzutage sind Experimente auch für uns, Schüler, sehr wichtig. Und zwar helfen sie im Chemieunterricht komplizierte Prozesse zu veranschaulichen und zu verstehen. So auch das Experiment vom blauen Wunder.
Inhaltsverzeichnis
Das blaue Wunder
Es ist ein altes, beliebtes Experiment, das eines der wichtigsten Prinzipien von chemischen Reaktionen demonstriert. Und zwar geht es um die Redox-Reaktion. Dazu jedoch später. Die Magie des blauen Wunders besteht darin, dass man eine Flasche, gefüllt mit durchsichtiger Flüssigkeit und Luft, schüttelt. Nach wenigen Sekunden verändert sich die Farbe der Flüssigkeit und wird blau. Wenn man nun die blaue Flüssigkeit in Ruhe lässt, wird sie nach kurzer Zeit wieder durchsichtig. Wie ist das möglich?Hier zum Video
Experimente durchführen
Beim Planen der Reaktion sollte man sich mögliche Ausgänge der Reaktion überlegen. Man sollte dabei sehr sorgfältig vorgehen. Während dem Experiment ist es auch wichtig, dass man mögliche Veränderungen genau beobachtet und gegebenenfalls auch Notizen macht. Wie schon früher erwähnt, ist das korrekte Aufstellen und das folgene Analysieren der Reaktionsgleichung das A und O in der Chemie.
Was passiert?
Auf den ersten Blick scheint das Experiment relativ einfach zu sein. Wenn man sich aber mehr mit den Strukturen und den jeweiligen Prozessen näher befasst, erkennt man die steigende Komplexität von diesem Versuch. Es stellt sich nun die Frage, warum die Flüssigkeit ihre Farbe ändern kann.
Der im Experiment verwendete Behälter(Erlenmeyerkolben) beinhaltet Glucose (Zucker), destilliertes Wasser, einen Farbstoff namens Methylenblau und Natronlauge (gelöstes Natriumhydroxid).
Hinreaktion (schütteln)
Allgemein gesehen geht es darum, dass sich Sauerstoff mit der Flüssigkeit vermischt. Somit reagiert der durchsichtige Farbstoff (Leukomethylenblau)mit Sauerstoff. Die Flüssigkeit wird blau. Bei der Reaktion werden vom durchsichtigen Farbstoff Elektronen gestohlen, er wird oxidiert. Das Schütteln und Durchmischen der Flüssigkeit bewirkt also einen Austausch von Elektronen zwischen dem Sauerstoff und dem durchsichtigen Farbstoff.
Leukomethylenblau (auch farbloses Methylenblau genannt) ist ein Farbstoff, der nur beim Verlust von Elektronen wieder seine Farbe erhält.
Rückreaktion (stehen lassen)
Jetzt ist die Lösung blau und wird im Laufe der Zeit wieder farblos, durchsichtig. Die von Glucose zur Verfügung gestellten Elektronen werden vom blauen Farbstoff(oxidiertem Methylenblau) wiederum gestohlen, d.h. Glucose wird oxidiert.
Man sollte auch betrachten, dass einst die Flüssigkeit durchsichtig wurde, sich eine dünne blaue Schicht an der Oberfläche bildet. Die Flüssigkeit kommt in direkten Kontakt mit dem Sauerstoff, es reagiert die Lösungsoberfläche mit der Luft. Dies beweist, dass Sauerstoff an der Reaktion beteiligt ist.
Wovon hängt die Stärke der Verfärbung ab?
Die zentrale Rolle in dieser chemischen Reaktion spielen Sauerstoff und Glucose.
- a.) Bei der Hinreaktion (Verfärbung) hängt die Intensität der blauen Farbe stark von der Sauerstoffkonzentration ab. Falls wenig Sauerstoff vorhanden ist oder beim Schütteln wenig mit dem durchsichtigen Methylenblau reagiert (oxidiert), wird die Flüssigkeit nur leicht verfärbt. Je mehr Sauerstoff in der Flüssigkeit gelöst wird, desto länger hält die Farbe. Deshalb ist die Länge und Stärke der Verfärbung auch vom Schütteln abhängig.
- b.) Die Rückreaktion hängt jedoch stark von der Konzentration der gelösten Glucose ab. Je mehr Glucose vorhanden ist, desto schneller kann der oxidierte Farbstoff wieder zurück reagieren. Grund dafür ist die Reaktion des Methylenblaus mit Glucose, was bekanntlich zu demdurchsichtigen Farbstoff Führt.
Weil man eine blaue Färbung sieht, muss man davon ausgehen, dass die Hinreaktion schneller ist als die Rückreaktion.
Bedeutung in der Chemie
Redoxreaktion
Einer der zentralen Begriffe in der Chemie ist die Redoxreaktion. Prinzipiell geht es um den Austausch von Elektronen. So wie in unserem Experiment betrachtet, gab es einen Austausch von Elektronen zwischen Leukomethylenblau → Sauerstoff und Glucose → Methylenblau. Der Austausch von Elektronen in dieser Richtung beschreibt eine Oxidation.
Der Begriff Redox kommt von der Reduktion und der Oxidation. Die Reduktion stellt die Aufnahme von Elektronen durch ein anderes Teilchen dar. Im Gegensatz dazu beschreibt die Oxidation den Verlust von Elektronen durch ein anderes Teilchen (Teilchen werden gestohlen). Diese zwei Begriffe passen deshalb zusammen, da in der Chemie Teilchen (z.B. Elektronen) nicht verloren gehen können. D.h. wenn sie irgendwo gestohlen werden, müssen sie dementsprechend auch irgendwo aufgenommen werden. Beispiel für eine Redoxreaktion: Ein Stoff A oxidiert einen Stoff B und wird dabei selbst reduziert.
Farbstoff als Katalysator
In dem blauen Wunder berwirkt der Farbstoff Methylenblau nicht nur die blaue Farbe, nimmt aber auch die Rolle des Katalysators ein. Mit dem Katalysator bezeichnet man in der Chemie einen Stoff, der die Geschwindigkeit einer chemischen Reaktion beschleunigt. In unserem Fall beschleunigt das Methylenblau die Reaktion von Sauerstoff und Glucose, zur oxidierten Glucose (Sauerstoff stiehlt der Glucose Elektronen).
Hier die Nettoreaktion:
Zusatzinformationen
Der Vorgang der Oxidation ist eine chemische Reaktion, bei der einem zu oxidierenden Stoff Elektronen gestohlen werden. In unserem Fall stiehlt der Sauerstoff Elektronen dem durchsichtigen Leukomethylenblau, es wird in das blaue Methylenblau umgewandelt. Umgekehrt stiehlt bei der Rückreaktion der oxidierte Farbstoff der Glucose Elektronen, womit Glucose oxidiert wird
Das Experiment ist Reproduzierbar, aber nur auf eine beschränkte Anzahl Versuche (ca. 20)! Nach einigen Stunden wird die Lösung gelb und farbliche Unterschiede kommen nicht mehr vor. Bei chemischen Reaktionen verbinden sich Stoffe, sie werden verbraucht und man kann sie im nachhinein nicht mehr trennen oder zurückgewinnen. Deshalb ist dieses Experiment nicht beliebig viel mal durchführbar.
Quellen
- Chemieunterlagen gestützt auf dem Wissen vom Herrn Deuber
- [1]
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
Authoren
SG & SP