Batterie: Unterschied zwischen den Versionen
(Inhaltsverzeichnis) |
|||
| Zeile 1: | Zeile 1: | ||
== Funktionsweise einer Batterie == | == Funktionsweise einer Batterie == | ||
| + | |||
| + | Das Grundprinzip einer Batterie basiert darauf, Elektronen aufgrund von [[Grundlagen_Redox|Redox-Reaktionen]] zu zwingen, von einem Ort an einen anderen zu fliessen. Es gibt verschiedene Möglichkeiten, das zu erreichen. | ||
| + | |||
| + | Beim Verbrennen von Aluminiumpulver gehen Elektronen vom Aluminium zum Sauerstoff über. Das ist eine exotherme Redox-Reaktion, bei der natürlich Energie freigesetzt wird. Nur ist diese Energie so nicht nutzbar. Wie kann man also nun dieses Prinzip nutzen, um daraus elektrischen Strom zu erzeugen? | ||
| + | |||
| + | Die Idee ist, die Elektronen, die bei der Reaktion umverteilt werden, nicht direkt zum Empfänger (auch Oxidator) fliessen zu lassen, sondern sie (zum Beispiel über die Batteriepole) umzuleiten. Dazu müssen die Oxidationsreaktion und die Reduktionsreaktion getrennt werden. Sie dürfen aber nicht vollständig getrennt werden, denn die Ladungen, die beim Elektronentransport entstehen, müssen ausgeglichen werden können. Sonst kommt der Transport zum Erliegen. | ||
=== Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle === | === Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle === | ||
| − | + | Wichtig für diesen Batterietyp ist, dass Elektronen ''Nichtschwimmer'' sind. Das heisst, sie können nicht in Wasser transportiert werden, auch wenn das Wassert gelöste Salze enthält. Dafür verantwortlich, dass in Salzwasser elektrischer Strom geleitet wird, sind nicht die Elektronen, sondern die gelösten Ionen, die dabei chemisch verändert werden. | |
| − | + | Füllt man eine Schale mit einer Kochsalzlösung und taucht sowohl eine Aluminiumfolie als auch einen Kohleblock, die beide miteinander über einen Verbraucher verbunden sind, in die Flüssigkeit, so erhält man einen Elektronenfluss von der Aluminiumfolie zum Kohleblock. Dieses Prinzip funktioniert, weil die Al<sup>3+</sup>- und die O<sup>2+</sup>-Ionen durch die Kochsalzlösung ausgeglichen werden können. Würde man die beiden Elektroden in einzelne Gefässe tauchen oder sie gar einfach an der Luft lassen, so gäbe es für die Ionen keinen weg, zu wandern und die Ladung wieder auszugleichen. | |
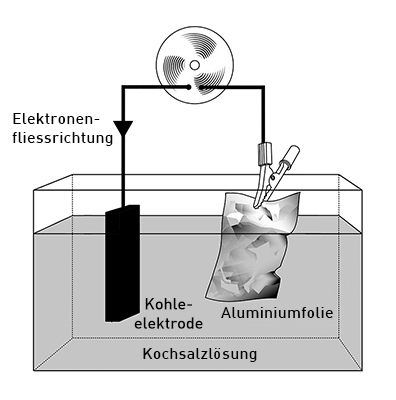
| − | ===== Elektronenfluss ===== | + | ==== Querschnitt mit Aufbau und Funktionen der verschiedenen Bestandteile ==== |
| + | |||
| + | [[image:Alu-Luft-Batterie_klein.jpg|center|Die Alu-Luft-Batterie]] | ||
| + | |||
| + | * Der Kohleblock links stellt den Oxidator dar, bei dem die Reduktion stattfindet. | ||
| + | * Die Alufolie rechts stellt den Reduktor dar, bei dem die Oxidation stattfindet. | ||
| + | * Der Ventolator oben stellt den Verbraucher dar, durch den die Elektronen von rechts nach links hindurchfliessen. | ||
| + | * Die Kochsalzlösung unten stellt die Ionenpermeable Trennung zwischen den Elektroden dar. | ||
| + | |||
| + | ===== Reaktion und Elektronenfluss ===== | ||
| + | |||
| + | Die Oxidation lautet: | ||
| + | :Al + 3 OH<sup>-</sup> → Al(OH)<sub>3</sub> + 3 e<sup>-</sup> | ||
| + | |||
| + | Die Reduktion lautet: | ||
| + | :O<sub>2</sub> + 2 H<sub>2</sub>O + 4 e<sup>-</sup> → 4 OH<sup>-</sup> | ||
| + | |||
| + | Die gesamte Redox-Reaktion lautet: | ||
| + | :4 Al + 3 O<sub>2</sub> + 6 H<sub>2</sub>O → 4 Al(OH)<sub>3</sub> | ||
| + | |||
| + | Aluminium befindet sich in der Gruppe 13 im [[C_Das_Periodensystem|Periodensystem]] und hält seine Elektronen nicht so stark wie Kohlenstoff, der sich rechts davon in der Gruppe 14 befindet. | ||
| + | Somit fliessen die Elektronen vom Aluminium zum Kohlenstoff. | ||
===== Ausgleich durch Separator ===== | ===== Ausgleich durch Separator ===== | ||
| − | === | + | Wie oben schon erwähnt, können Elektronen nicht durch Wasser transportiert werden; auch nicht durch eine Kochsalzlösung. Sie sind somit gezwungen, den längeren und beschwerlicheren Weg über den Verbraucher zu nehmen. Das tun sie aber trotzdem gerne, weil sie von Kohlenstoff stärker angezogen werden als von Aluminium. Weil sich die negative Ladung aber nun zum Oxidator verschiebt, folgen die entstandenen positiv geladenen Al<sup>3+</sup>-Ionen über den kürzeren Weg, die Kochsalzlösung. |
| + | |||
| + | === Konkurrenz-Reaktionen === | ||
| − | + | // TODO | |
=== Ladung, Spannung, Stromstärke, Leistung, Energiegehalt === | === Ladung, Spannung, Stromstärke, Leistung, Energiegehalt === | ||
| + | |||
| + | {| class="wikitable" | ||
| + | |- | ||
| + | ! Grösse !! Symbol !! Einheit !! Beschreibung und Zusammenhänge | ||
| + | |- | ||
| + | | Ladung || Q || Coulomb [C] || Ein Coulomb entspricht der Ladung von etwas mehr als einem Mikromol Elektronen. Ladungen werden oft als Ampèrestunden angegeben. | ||
| + | |- | ||
| + | | Spannung || U || Volt [V] || Die Spannung ist ein Mass für die Energie, die ein Elektron transportiert und ist vom Reduktor und dem Oxidator abhängig. | ||
| + | |- | ||
| + | | Stromstärke || I || Ampère [A] || Ein Ampère entspricht dem Fluss von einem Coulomb pro Sekunde. | ||
| + | |- | ||
| + | | Leistung || P || Watt [W] || Je grösser die Spannung und die Stromstärke sind, desto grösser ist auch die Leistung: P = U × I | ||
| + | |- | ||
| + | | Energiegehalt || E || Joule [J] || W = U × Q | ||
| + | |} | ||
| + | :Enthält Inhalte aus der Tabelle auf Seite 29 im Skript ''Mobile Energiequellen'' | ||
==== Berechnung der Spannung (Vergleich mit Wasserstoff) ==== | ==== Berechnung der Spannung (Vergleich mit Wasserstoff) ==== | ||
| + | |||
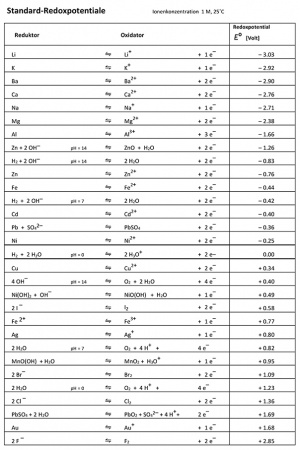
| + | [[image:Redoxpotenziale.jpg|thumb|right|Eine Tabelle der Standard-Redoxpotenziale]] | ||
| + | |||
| + | Wie oben in der Tabelle zu lesen, ist die Spannung ein Mass für die Energie, die ein Elektron transportiert. Sie ist von Reduktor (wo die Oxidation stattfindet) und dem Oxidator (wo die Reduktion stattfindet) abhängig. Je nachdem, wie stark diese die Elektronen anziehen, variiert auch die Spannung zwischen den beiden. Man kann also sagen, die Spannung zeigt en Unterschied der Tendenz der beiden Elektroden, Elektronen anzuziehen | ||
| + | |||
| + | Um die sogenannten Redoxpotenziale tabellarisch darstellen zu können, hat man sich auf einen Referenzstoff mittleren Redoxpotenzials geeinigt, nämlich Wassertoff (H). | ||
| + | Da die zu messenden Stoffe nach Abgabe von Elektronen wieder bereit sind, neue Elektronen aufzunehmen, misst man bei Lithium zum Beipiel Li/Li<sup>+</sup>, bei Fluor F<sub>2</sub>/F<sup>-</sup> und beim Referenzstoff Wasserstoff H<sub>2</sub>/H<sup>+</sup>. | ||
| + | |||
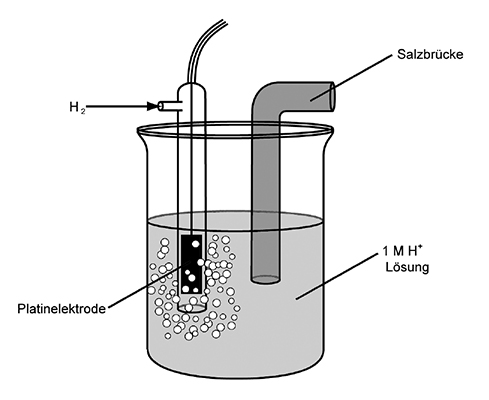
| + | Eine ''Messeinheit'', die aus zwei Gefässen mit den beiden Redox-Paaren besteht, die für den Ladungsausgleich durch eine Salzbrücke miteinander verbunden sind, nennt man ''Zelle''; ein einzelnes Gefäss heisst somit ''Halbzelle''. Die Standardhalbzelle mit dem Referenzstoff Wasserstoff sieht folgendermassen aus: | ||
| + | |||
| + | [[image:Standardhalbzelle.jpg|center|Die Standardhalbzelle zur Messung der Redoxpotenziale]] | ||
| + | |||
| + | * Durch den Glaskolben wird gasförmiger Wasserstoff geblasen | ||
| + | * Die weiter unten hängende Platinelektrode wird vom Wasserstoff umspült | ||
| + | * Die Salzbrücke dient zur Ionenwanderung | ||
| + | * Das ganze taucht in einer einmoligen H<sup>+</sup>-Lösung | ||
| + | |||
| + | Durch das Verbinden der Standardhalbzelle mit allen anderen Halbzellen kann die entstehende Spannung gemessen und in eine Tabelle eingetragen werden. Mit diesen Werten kann dann die Spannung zwischen zwei beliebigen Redox-Partnern ungefähr berechnet werden. Natürlich kann es in der Realität zu kleineren Abweichungen kommen. | ||
| + | |||
| + | :Standard-Zellspannung = Redoxpotenzial<sub>Oxidator</sub> - Redoxpotenzial<sub>Reduktor</sub> | ||
| + | |||
| + | Um mit der Tabelle besser arbeiten zu können, kann man sich folgende Regeln merken: | ||
| + | * Oben links sind die starken Reduktoren un dunten rechts die starken Oxidatoren. | ||
| + | * Befindet sich der Reduktor in der Tabelle weiter oben als der Oxidator, so findet ein Elektronenfluss statt. | ||
| + | * Befindet sich der Reduktor in der Tabelle weiter unten als der Oxidator, so findet kein Elektronenfluss statt. | ||
| + | * Je stärker das Gefälle von Reduktor (oben links) zum Oxidator (unten rechts) ist, desto höher ist die Spannung. | ||
== Beispiele von Batterietypen == | == Beispiele von Batterietypen == | ||
| Zeile 24: | Zeile 95: | ||
==== Funktion, Reaktionsgleichung ==== | ==== Funktion, Reaktionsgleichung ==== | ||
| + | |||
| + | Die Funktion der Alkali-Mangan-Zelle ähnelt der der Alu-Luft-Batterie; sie hat jedoch andere Inhaltsstoffe: Statt Kohle dient hier Manganoxid (MnO<sub>2</sub>), auch Braunstein genannt, als Oxidator. In einem Gel verteiltes Zinkpulver, das mehr Oberfläche als Nicht-Pulver hat und, anders als Aluminium, keine undurchdringliche Oxidschicht bildet, übernimmt die Arbeit der Aluminium-Folie und somit des die des Reduktors. Ein Separator aus Zellstoff, getränkt in KOH und durchlässig für Zink- und Hydroxid-Ionen, ersetzt die Kochsalzlösung. | ||
| + | |||
| + | Reduktionsreaktion: | ||
| + | :MnO<sub>2</sub> + e<sup>-</sup> + H<sub>2</sub>O → MnOOH + OH<sup>-</sup> | ||
| + | |||
| + | Oxidationsreaktion: | ||
| + | :Zn + 4 OH<sup>-</sup> → [Zn<sup>2+</sup>(OH<sup>-</sup>)<sub>4</sub>]<sup>2-</sup> + 2 e<sup>-</sup> | ||
==== Vor- und Nachteile, Anwendungsbereiche ==== | ==== Vor- und Nachteile, Anwendungsbereiche ==== | ||
| + | |||
| + | Die Alkali-Mangan-Batterie ist die heutzutage weltweit meistverbreitete Batterie. | ||
===== Vorteile gegenüber Kohle-Zink-Zelle ===== | ===== Vorteile gegenüber Kohle-Zink-Zelle ===== | ||
| Zeile 47: | Zeile 128: | ||
==== Vor- und Nachteile, Anwendungsbereiche ==== | ==== Vor- und Nachteile, Anwendungsbereiche ==== | ||
| − | === Lithium- | + | === Lithium-Mangan<sub>2</sub>-Zelle === |
==== Funktion, Reaktionsgleichung ==== | ==== Funktion, Reaktionsgleichung ==== | ||
| Zeile 70: | Zeile 151: | ||
==== Berechnung ==== | ==== Berechnung ==== | ||
| + | |||
| + | == Quellen == | ||
| + | * Unterrichtseinheit ''Mobile Energiequellen'' | ||
| + | * Chemieunterricht bei Herrn Deuber | ||
Version vom 18. Juni 2016, 17:39 Uhr
Inhaltsverzeichnis
- 1 Funktionsweise einer Batterie
- 2 Beispiele von Batterietypen
- 3 Knopfzellen
- 4 Akkumulatoren
- 5 Quellen
Funktionsweise einer Batterie
Das Grundprinzip einer Batterie basiert darauf, Elektronen aufgrund von Redox-Reaktionen zu zwingen, von einem Ort an einen anderen zu fliessen. Es gibt verschiedene Möglichkeiten, das zu erreichen.
Beim Verbrennen von Aluminiumpulver gehen Elektronen vom Aluminium zum Sauerstoff über. Das ist eine exotherme Redox-Reaktion, bei der natürlich Energie freigesetzt wird. Nur ist diese Energie so nicht nutzbar. Wie kann man also nun dieses Prinzip nutzen, um daraus elektrischen Strom zu erzeugen?
Die Idee ist, die Elektronen, die bei der Reaktion umverteilt werden, nicht direkt zum Empfänger (auch Oxidator) fliessen zu lassen, sondern sie (zum Beispiel über die Batteriepole) umzuleiten. Dazu müssen die Oxidationsreaktion und die Reduktionsreaktion getrennt werden. Sie dürfen aber nicht vollständig getrennt werden, denn die Ladungen, die beim Elektronentransport entstehen, müssen ausgeglichen werden können. Sonst kommt der Transport zum Erliegen.
Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle
Wichtig für diesen Batterietyp ist, dass Elektronen Nichtschwimmer sind. Das heisst, sie können nicht in Wasser transportiert werden, auch wenn das Wassert gelöste Salze enthält. Dafür verantwortlich, dass in Salzwasser elektrischer Strom geleitet wird, sind nicht die Elektronen, sondern die gelösten Ionen, die dabei chemisch verändert werden.
Füllt man eine Schale mit einer Kochsalzlösung und taucht sowohl eine Aluminiumfolie als auch einen Kohleblock, die beide miteinander über einen Verbraucher verbunden sind, in die Flüssigkeit, so erhält man einen Elektronenfluss von der Aluminiumfolie zum Kohleblock. Dieses Prinzip funktioniert, weil die Al3+- und die O2+-Ionen durch die Kochsalzlösung ausgeglichen werden können. Würde man die beiden Elektroden in einzelne Gefässe tauchen oder sie gar einfach an der Luft lassen, so gäbe es für die Ionen keinen weg, zu wandern und die Ladung wieder auszugleichen.
Querschnitt mit Aufbau und Funktionen der verschiedenen Bestandteile
- Der Kohleblock links stellt den Oxidator dar, bei dem die Reduktion stattfindet.
- Die Alufolie rechts stellt den Reduktor dar, bei dem die Oxidation stattfindet.
- Der Ventolator oben stellt den Verbraucher dar, durch den die Elektronen von rechts nach links hindurchfliessen.
- Die Kochsalzlösung unten stellt die Ionenpermeable Trennung zwischen den Elektroden dar.
Reaktion und Elektronenfluss
Die Oxidation lautet:
- Al + 3 OH- → Al(OH)3 + 3 e-
Die Reduktion lautet:
- O2 + 2 H2O + 4 e- → 4 OH-
Die gesamte Redox-Reaktion lautet:
- 4 Al + 3 O2 + 6 H2O → 4 Al(OH)3
Aluminium befindet sich in der Gruppe 13 im Periodensystem und hält seine Elektronen nicht so stark wie Kohlenstoff, der sich rechts davon in der Gruppe 14 befindet. Somit fliessen die Elektronen vom Aluminium zum Kohlenstoff.
Ausgleich durch Separator
Wie oben schon erwähnt, können Elektronen nicht durch Wasser transportiert werden; auch nicht durch eine Kochsalzlösung. Sie sind somit gezwungen, den längeren und beschwerlicheren Weg über den Verbraucher zu nehmen. Das tun sie aber trotzdem gerne, weil sie von Kohlenstoff stärker angezogen werden als von Aluminium. Weil sich die negative Ladung aber nun zum Oxidator verschiebt, folgen die entstandenen positiv geladenen Al3+-Ionen über den kürzeren Weg, die Kochsalzlösung.
Konkurrenz-Reaktionen
// TODO
Ladung, Spannung, Stromstärke, Leistung, Energiegehalt
| Grösse | Symbol | Einheit | Beschreibung und Zusammenhänge |
|---|---|---|---|
| Ladung | Q | Coulomb [C] | Ein Coulomb entspricht der Ladung von etwas mehr als einem Mikromol Elektronen. Ladungen werden oft als Ampèrestunden angegeben. |
| Spannung | U | Volt [V] | Die Spannung ist ein Mass für die Energie, die ein Elektron transportiert und ist vom Reduktor und dem Oxidator abhängig. |
| Stromstärke | I | Ampère [A] | Ein Ampère entspricht dem Fluss von einem Coulomb pro Sekunde. |
| Leistung | P | Watt [W] | Je grösser die Spannung und die Stromstärke sind, desto grösser ist auch die Leistung: P = U × I |
| Energiegehalt | E | Joule [J] | W = U × Q |
- Enthält Inhalte aus der Tabelle auf Seite 29 im Skript Mobile Energiequellen
Berechnung der Spannung (Vergleich mit Wasserstoff)
Wie oben in der Tabelle zu lesen, ist die Spannung ein Mass für die Energie, die ein Elektron transportiert. Sie ist von Reduktor (wo die Oxidation stattfindet) und dem Oxidator (wo die Reduktion stattfindet) abhängig. Je nachdem, wie stark diese die Elektronen anziehen, variiert auch die Spannung zwischen den beiden. Man kann also sagen, die Spannung zeigt en Unterschied der Tendenz der beiden Elektroden, Elektronen anzuziehen
Um die sogenannten Redoxpotenziale tabellarisch darstellen zu können, hat man sich auf einen Referenzstoff mittleren Redoxpotenzials geeinigt, nämlich Wassertoff (H). Da die zu messenden Stoffe nach Abgabe von Elektronen wieder bereit sind, neue Elektronen aufzunehmen, misst man bei Lithium zum Beipiel Li/Li+, bei Fluor F2/F- und beim Referenzstoff Wasserstoff H2/H+.
Eine Messeinheit, die aus zwei Gefässen mit den beiden Redox-Paaren besteht, die für den Ladungsausgleich durch eine Salzbrücke miteinander verbunden sind, nennt man Zelle; ein einzelnes Gefäss heisst somit Halbzelle. Die Standardhalbzelle mit dem Referenzstoff Wasserstoff sieht folgendermassen aus:
- Durch den Glaskolben wird gasförmiger Wasserstoff geblasen
- Die weiter unten hängende Platinelektrode wird vom Wasserstoff umspült
- Die Salzbrücke dient zur Ionenwanderung
- Das ganze taucht in einer einmoligen H+-Lösung
Durch das Verbinden der Standardhalbzelle mit allen anderen Halbzellen kann die entstehende Spannung gemessen und in eine Tabelle eingetragen werden. Mit diesen Werten kann dann die Spannung zwischen zwei beliebigen Redox-Partnern ungefähr berechnet werden. Natürlich kann es in der Realität zu kleineren Abweichungen kommen.
- Standard-Zellspannung = RedoxpotenzialOxidator - RedoxpotenzialReduktor
Um mit der Tabelle besser arbeiten zu können, kann man sich folgende Regeln merken:
- Oben links sind die starken Reduktoren un dunten rechts die starken Oxidatoren.
- Befindet sich der Reduktor in der Tabelle weiter oben als der Oxidator, so findet ein Elektronenfluss statt.
- Befindet sich der Reduktor in der Tabelle weiter unten als der Oxidator, so findet kein Elektronenfluss statt.
- Je stärker das Gefälle von Reduktor (oben links) zum Oxidator (unten rechts) ist, desto höher ist die Spannung.
Beispiele von Batterietypen
Alkali-Mangan-Zelle
Funktion, Reaktionsgleichung
Die Funktion der Alkali-Mangan-Zelle ähnelt der der Alu-Luft-Batterie; sie hat jedoch andere Inhaltsstoffe: Statt Kohle dient hier Manganoxid (MnO2), auch Braunstein genannt, als Oxidator. In einem Gel verteiltes Zinkpulver, das mehr Oberfläche als Nicht-Pulver hat und, anders als Aluminium, keine undurchdringliche Oxidschicht bildet, übernimmt die Arbeit der Aluminium-Folie und somit des die des Reduktors. Ein Separator aus Zellstoff, getränkt in KOH und durchlässig für Zink- und Hydroxid-Ionen, ersetzt die Kochsalzlösung.
Reduktionsreaktion:
- MnO2 + e- + H2O → MnOOH + OH-
Oxidationsreaktion:
- Zn + 4 OH- → [Zn2+(OH-)4]2- + 2 e-
Vor- und Nachteile, Anwendungsbereiche
Die Alkali-Mangan-Batterie ist die heutzutage weltweit meistverbreitete Batterie.
Vorteile gegenüber Kohle-Zink-Zelle
Alu-Luft-Batterie
Funktion, Reaktionsgleichung
Vor- und Nachteile, Anwendungsbereiche
Silberoxid-Zink-Zelle
Funktion, Reaktionsgleichung
Vor- und Nachteile, Anwendungsbereiche
Zink-Luft-Zelle
Funktion, Reaktionsgleichung
Vor- und Nachteile, Anwendungsbereiche
Lithium-Mangan2-Zelle
Funktion, Reaktionsgleichung
Vor- und Nachteile, Anwendungsbereiche
Knopfzellen
Anwendungsbereiche
Akkumulatoren
Beispiel der Funktionsweise am Blei-Akku
Funktion, Reaktionsgleichung
Lithium-Ionen-Akku
Funktion, Reaktionsgleichung
Haltbarkeit von Akkus
Berechnung
Quellen
- Unterrichtseinheit Mobile Energiequellen
- Chemieunterricht bei Herrn Deuber