Batterie: Unterschied zwischen den Versionen
K |
|||
| (Eine dazwischenliegende Version desselben Benutzers wird nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
== Funktionsweise einer Batterie == | == Funktionsweise einer Batterie == | ||
| − | + | Das Grundprinzip einer Batterie basiert darauf, dass Elektronen aufgrund von [[Grundlagen_Redox|Redox-Reaktionen]] zu wandern beginnen, also von einem Ort an einen anderen zu fliessen. Das liegt daran, dass der Oxidator Elektronen stärker anzieht als der Reduktor. | |
| − | |||
| − | Das Grundprinzip einer Batterie basiert darauf, Elektronen aufgrund von [[Grundlagen_Redox|Redox-Reaktionen]] zu | ||
Beim Verbrennen von Aluminiumpulver gehen Elektronen vom Aluminium zum Sauerstoff über. Das ist eine exotherme Redox-Reaktion, bei der natürlich Energie freigesetzt wird. Nur ist diese Energie so nicht nutzbar. Wie kann man also nun dieses Prinzip nutzen, um daraus elektrischen Strom zu erzeugen? | Beim Verbrennen von Aluminiumpulver gehen Elektronen vom Aluminium zum Sauerstoff über. Das ist eine exotherme Redox-Reaktion, bei der natürlich Energie freigesetzt wird. Nur ist diese Energie so nicht nutzbar. Wie kann man also nun dieses Prinzip nutzen, um daraus elektrischen Strom zu erzeugen? | ||
| Zeile 11: | Zeile 9: | ||
=== Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle === | === Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle === | ||
| − | Wichtig für diesen | + | Wichtig für diesen und andere Batterietypen ist, dass Elektronen ''Nichtschwimmer'' sind. Das heisst, sie können nicht in Wasser transportiert werden, auch wenn das Wasser gelöste Salze enthält. Dafür verantwortlich, dass in Salzwasser elektrischer Strom geleitet wird, sind nicht die Elektronen, sondern die gelösten Ionen, die dabei chemisch verändert werden. |
| − | Füllt man eine Schale mit einer Kochsalzlösung und taucht sowohl eine Aluminiumfolie als auch | + | Füllt man eine Schale mit einer Kochsalzlösung und taucht sowohl eine Aluminiumfolie als auch eine Kohleelektrode, die beide miteinander über einen Verbraucher verbunden sind, in die Flüssigkeit, so erhält man einen Elektronenfluss von der Aluminiumfolie zur Kohleelektrode. Dieses Prinzip funktioniert, weil die Al<sup>3+</sup>- und die O<sup>2+</sup>-Ionen durch die Kochsalzlösung ausgeglichen werden können. Würde man die beiden Elektroden in einzelne Gefässe tauchen oder sie gar einfach an der Luft lassen, so gäbe es für die Ionen keinen Weg, zu wandern und die Ladung wieder auszugleichen. Ausserdem lösen die Chlorid-Ionen aus der Lösung die Aluminium-Schutzschicht auf. |
==== Aufbau und Funktionen der verschiedenen Bestandteile ==== | ==== Aufbau und Funktionen der verschiedenen Bestandteile ==== | ||
| Zeile 19: | Zeile 17: | ||
[[image:Alu-Luft-Batterie_klein.jpg|center|Die Alu-Luft-Batterie]] | [[image:Alu-Luft-Batterie_klein.jpg|center|Die Alu-Luft-Batterie]] | ||
| − | * | + | * Die Kohleelektrode links stellt den Katalysator für die Reduktion dar. |
* Die Alufolie rechts stellt den Reduktor dar, bei dem die Oxidation stattfindet. | * Die Alufolie rechts stellt den Reduktor dar, bei dem die Oxidation stattfindet. | ||
| − | * Der | + | * Der Drehmotor oben stellt den Verbraucher dar, durch den die Elektronen von rechts nach links hindurchfliessen. |
| − | * Die Kochsalzlösung unten stellt die | + | * Die Kochsalzlösung unten stellt die ionenpermeable Trennung zwischen den Elektroden dar, durch die der Ladungsausgleich erfolgt. Es löst sich die Al<sub>2</sub>O<sub>3</sub>-Schutzschicht auf. |
===== Reaktion und Elektronenfluss ===== | ===== Reaktion und Elektronenfluss ===== | ||
| Zeile 35: | Zeile 33: | ||
:4 Al + 3 O<sub>2</sub> + 6 H<sub>2</sub>O → 4 Al(OH)<sub>3</sub> | :4 Al + 3 O<sub>2</sub> + 6 H<sub>2</sub>O → 4 Al(OH)<sub>3</sub> | ||
| − | Aluminium befindet sich in der dritten Hauptgruppe des [[C_Das_Periodensystem|Periodensystems]] und hält seine Elektronen nicht so stark wie | + | Aluminium befindet sich in der dritten Hauptgruppe des [[C_Das_Periodensystem|Periodensystems]] und hält seine Elektronen nicht so stark wie Sauerstoff, der sich rechts davon in der vierten Hauptgruppe befindet. |
| − | Somit fliessen die Elektronen vom Aluminium zum | + | Somit fliessen die Elektronen vom Aluminium zum Sauerstoff. |
| − | |||
| − | |||
| − | |||
| − | |||
| − | === | + | ===== Ladungsausgleich durch Separator ===== |
| − | + | Wie oben schon erwähnt, können Elektronen nicht durch Wasser transportiert werden; auch nicht durch eine Kochsalzlösung. Sie sind somit gezwungen, den längeren und beschwerlicheren Weg über den Verbraucher zu nehmen. Das tun sie aber trotzdem gerne, weil sie von Sauerstoff stärker angezogen werden als von Aluminium. Weil sich die negative Ladung aber nun zum Oxidator verschiebt, folgen die entstandenen positiv geladenen Ionen (hier: Al<sup>3+</sup>-Ionen) über den kürzeren Weg, die Kochsalzlösung. | |
=== Ladung, Spannung, Stromstärke, Leistung, Energiegehalt === | === Ladung, Spannung, Stromstärke, Leistung, Energiegehalt === | ||
| Zeile 71: | Zeile 65: | ||
Um die sogenannten Redoxpotenziale tabellarisch darstellen zu können, hat man sich auf einen Referenzstoff mittleren Redoxpotenzials geeinigt, nämlich Wassertoff (H). | Um die sogenannten Redoxpotenziale tabellarisch darstellen zu können, hat man sich auf einen Referenzstoff mittleren Redoxpotenzials geeinigt, nämlich Wassertoff (H). | ||
| − | Da die zu messenden Stoffe nach Abgabe von Elektronen wieder bereit sind, neue Elektronen aufzunehmen, nimmt man für Lithium Li/Li<sup>+</sup>, bei Fluor F<sub>2</sub>/F<sup>-</sup> und beim | + | Da die zu messenden Stoffe nach Abgabe von Elektronen wieder bereit sind, neue Elektronen aufzunehmen, nimmt man für Lithium Li/Li<sup>+</sup>, bei Fluor F<sub>2</sub>/F<sup>-</sup> und beim der Standardwasserstoffhalbzelle Wasserstoff H<sub>2</sub>/H<sup>+</sup>. Also immer das jeweilige Redoxpaar. |
Eine ''Messeinheit'', die aus zwei Gefässen mit den beiden Redox-Paaren besteht, die für den Ladungsausgleich durch eine Salzbrücke miteinander verbunden sind, nennt man ''Zelle''; ein einzelnes Gefäss heisst somit ''Halbzelle''. Die Standardhalbzelle mit dem Referenzstoff Wasserstoff sieht folgendermassen aus: | Eine ''Messeinheit'', die aus zwei Gefässen mit den beiden Redox-Paaren besteht, die für den Ladungsausgleich durch eine Salzbrücke miteinander verbunden sind, nennt man ''Zelle''; ein einzelnes Gefäss heisst somit ''Halbzelle''. Die Standardhalbzelle mit dem Referenzstoff Wasserstoff sieht folgendermassen aus: | ||
| Zeile 79: | Zeile 73: | ||
* Durch den Glaskolben wird gasförmiger Wasserstoff geblasen | * Durch den Glaskolben wird gasförmiger Wasserstoff geblasen | ||
* Die weiter unten hängende Platinelektrode wird vom Wasserstoff umspült | * Die weiter unten hängende Platinelektrode wird vom Wasserstoff umspült | ||
| − | * | + | * Eine Salzbrücke dient zur Ionenwanderung |
* Das Ganze taucht in einer einmolaren H<sup>+</sup>-Lösung | * Das Ganze taucht in einer einmolaren H<sup>+</sup>-Lösung | ||
| Zeile 92: | Zeile 86: | ||
* Je stärker das Gefälle von Reduktor (oben links) zum Oxidator (unten rechts) ist, desto höher ist die Spannung. | * Je stärker das Gefälle von Reduktor (oben links) zum Oxidator (unten rechts) ist, desto höher ist die Spannung. | ||
| − | ==== | + | == Beispiele von Batterietypen als Knopfzellen == |
| + | |||
| + | === Knopfzellen === | ||
| − | + | ==== Anwendungsbereiche ==== | |
| − | + | Knopfzellen werden in vielen verschiedenen elektronischen Geräten mit verschiedenen Anforderungen eingesetzt. Beispiele für Geräte mit tiefem Strombedarf etwa sind kleinere Wecker, Armbanduhren, Waagen, Drahtloskopfhörer oder auch Musikgratulationskarten. Knopfzellen können aber ihre Anwendung auch in Geräten mit hohen Ansprüchen auf Verlässlichkeit wie zum Beispiel Herzschrittmachern finden. | |
| + | ''Für eine Liste von Batterie- und Anwendungstypen siehe: [[Batterie#Beispiele_von_Batterietypen|Beispiele von Batterietypen]]'' | ||
=== Alkali-Mangan-Zelle === | === Alkali-Mangan-Zelle === | ||
| + | |||
| + | [[image:Batterie-Querschnitt.jpg|thumb|right|Querschnitt der Alkali-Mangan-Batterie]] | ||
==== Funktion, Reaktionsgleichung ==== | ==== Funktion, Reaktionsgleichung ==== | ||
| − | Die Funktion der Alkali-Mangan-Zelle ähnelt der der Alu-Luft-Batterie; sie hat jedoch andere Inhaltsstoffe: Statt | + | Die Funktion der Alkali-Mangan-Zelle ähnelt der der Alu-Luft-Batterie; sie hat jedoch andere Inhaltsstoffe: Statt Sauerstoff dient hier Mangandioxid (MnO<sub>2</sub>), auch Braunstein genannt, als Oxidator. In einem Gel verteiltes Zinkpulver, das mehr Oberfläche als Feststoff hat und, anders als Aluminium, keine undurchdringliche Oxidschicht bildet, übernimmt die Arbeit der Aluminium-Folie und somit die des Reduktors. Ein Separator aus Zellstoff, getränkt in KOH und durchlässig für Zink- und Hydroxid-Ionen, ersetzt die Kochsalzlösung. Er sorgt dafür, dass ein Ladungsausgleich stattfinden kann, die Elektronen aber trotzdem den Weg durch den Stromverbraucher nehmen müssen. |
Reduktionsreaktion: | Reduktionsreaktion: | ||
| Zeile 117: | Zeile 116: | ||
Die Alkali-Mangan-Batterie ist die heutzutage weltweit meistverbreitete Batterie. Sie ist billig und man stellt an sie keine hohen Qualitätsanforderungen. Ihre Spannung nimmt nämlich während des Betriebs kontinuiertlich ab. Ihre Energiedichte ist mittelmässig, die Kapazität aber gering. Man verwendet sie somit für Spielzeuge oder Billiguhren. | Die Alkali-Mangan-Batterie ist die heutzutage weltweit meistverbreitete Batterie. Sie ist billig und man stellt an sie keine hohen Qualitätsanforderungen. Ihre Spannung nimmt nämlich während des Betriebs kontinuiertlich ab. Ihre Energiedichte ist mittelmässig, die Kapazität aber gering. Man verwendet sie somit für Spielzeuge oder Billiguhren. | ||
| − | + | Berechnete Spannung: | |
:(0.95V) - (-0.76V) = 1.71V | :(0.95V) - (-0.76V) = 1.71V | ||
| + | |||
| + | ==== Abnahme der Spannung über Zeit von Knopfzellen ==== | ||
| + | |||
| + | Die Leistungsfähigkeit von Kohle-Zink-Batterien nimmt wesentlich schneller ab als die von Alkali-Mangan-Batterien. In beiden Typen befinden sich Zn<sup>2+</sup>-Ionen. Dass die Leistungsfähigkeit abnimmt, liegt daran, dass die Zn<sup>2+</sup>-Ionen in Kohle-Zink-Batterien mit Cl<sup>-</sup>-Ionen, die vom Ammoniumchlorid als Elektrolyt zugegeben werden, einen festen Niederschlag bilden, während die Zn<sup>2+</sup>-Ionen in Alkali-Mangan-Batterien lange gelöst bleiben. Durch den Niederschlag nimmt die Ionenwanderung ab und mit ihr der Ladungsausgleich, was die Leistungsfähigkeit dann schnell sinken lässt. Noch dazu diffundieren die Zn<sup>2+</sup>-Ionen infolge dessen langsamer vom Minuspol weg: Die Rückreaktion steigt und die Leistungsfähigkeit sinkt noch tiefer. | ||
=== Alu-Luft-Batterie === | === Alu-Luft-Batterie === | ||
| Zeile 177: | Zeile 180: | ||
==== Vor- und Nachteile, Anwendungsbereiche ==== | ==== Vor- und Nachteile, Anwendungsbereiche ==== | ||
| − | Die Kapazität der Lithium-Mangan-Batterie hält sich im Rahmen, ihre Energiedichte ist aber aufgrund der hohen Spannung | + | Die Kapazität der Lithium-Mangan-Batterie hält sich im Rahmen, ihre Energiedichte ist aber aufgrund der hohen Spannung sehr gross. Der minimale Abfall der Spannung über Zeit der Benutzung ist vernachlässigbar. Bei zu hoher Spannung kann sich aus dem Wasser aber Wasserstoff bilden, das sich natürlich aufgrund der geringeren Dichte von Gasen[https://de.wikipedia.org/wiki/W%C3%A4rmeausdehnung#Gase] ausdehnt und die Batterie zum Platzen und somit zum Auslaufen bringen kann. Zusammen mit dem Sauerstoff von aussen bildet Wasserstoff dann ein Knallgas und wird so gefährlich. Zum Glück wird bei der Herstellung von Batterien dieses Typs stark darauf geachtet, dass das nicht passieren kann. Geeignet sind sie vor allem für teurere Geräte wie Fotoapparate oder solche mit militärischer Anwendung. |
''Siehe auch: [[Batterie#Konkurrenz-Reaktionen|Konkurrenz-Reaktionen]]'' | ''Siehe auch: [[Batterie#Konkurrenz-Reaktionen|Konkurrenz-Reaktionen]]'' | ||
| Zeile 184: | Zeile 187: | ||
:(0.95V) - (-3.03V) = 3.98V | :(0.95V) - (-3.03V) = 3.98V | ||
| − | == | + | === Konkurrenz-Reaktionen === |
| − | + | Damit sich in einer Batterie die Ionen für den Ladungsausgleich bewegen können, müssen sie in einem polaren Lösungsmittel gelöst sein. Normalerweise ist das Wasser. Das Sauerstoffatom in H<sub>2</sub>O hat mit den beiden H-Atomen zwar schon genug Elektronen. Bietet ein Reduktor seine Elektronen aber so schön an, nimmt das Sauerstoffatom lieber ein vom Reduktor kommendes Elektron auf, statt sich eines in einer [[Abschätzen_der_Reaktionsenthalpie#Elektronenpaarbindungen|Elektronenpaarbindung]] mit einem Wasserstoffatom zu teilen. Wenn das Redoxpotenzial der Reaktion nicht allzu gross ist, dann ist der Vorgang zwar spontan, aber glücklicherweise sehr oft kinetisch gehemmt, da die Aktivierungsenergie sehr gross ist. Dadurch wird die Reaktion so langsam, dass sie eigentlich nicht mehr abläuft. Bei Lithium ist das hingegen anders: Hier ist das Valenzelektron so schwach gebunden, dass das leicht zu einem Verhängnis werden kann. Lithium-Ionen-Batterien beinhalten deshalb andere polare Lösungsmittel als Wasser. | |
| − | |||
| − | |||
| − | |||
== Akkumulatoren == | == Akkumulatoren == | ||
| − | Im Unterschied zu den Primärbatterien, die oben behandelt werden, können Akkumulatoren (besser bekannt als ''Akkus'') | + | Im Unterschied zu den Primärbatterien, die oben behandelt werden, können Akkumulatoren (besser bekannt als ''Akkus'') wieder aufgeladen werden. Für die längste Lebenszeit empfiehlt sich der im Abschnitt ''[[Batterie#Haltbarkeit_von_Akkus|Haltbarkeit von Akkus]]'' beschriebene Umgang mit ihnen. |
=== Beispiel der Funktionsweise am Blei-Akku === | === Beispiel der Funktionsweise am Blei-Akku === | ||
| Zeile 199: | Zeile 199: | ||
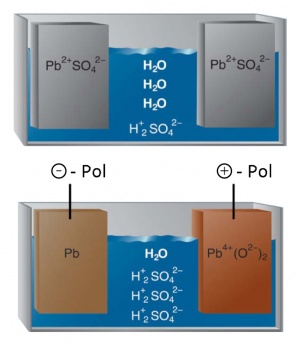
[[image:Blei-Akku.jpg|thumb|right|Prinzip des Bleiakkus]] | [[image:Blei-Akku.jpg|thumb|right|Prinzip des Bleiakkus]] | ||
| − | Bleiakkus sind vor allem als | + | Bleiakkus sind vor allem als Starterbatterien in Fahrzeugen bekannt. Sie weisen einen erstaunlich langsamen Alterungsprozess auf. Das liegt vor allem daran, dass sowohl die positive als auch die negative Elektrode aus Blei bestehen und allgemein gilt immer: ''Weniger verschiedene Elemente'' heisst ''weniger Möglichkeiten für ungewollte Reaktionen''. |
==== Funktion, Reaktionsgleichung ==== | ==== Funktion, Reaktionsgleichung ==== | ||
| − | Im entladenen Zustand besteht sowohl der negative als auch der positive Pol aus Bleisulfat- | + | Im entladenen Zustand besteht sowohl der negative als auch der positive Pol aus Bleisulfat-Salz (Pb<sup>2+</sup>SO<sub>4</sub><sup>2-</sup>). |
| − | Im geladenen Zustand bestehen immer noch beide Pole aus Blei, dem jetzt vierfach geladenen Pb<sup>4+</sup> | + | Im geladenen Zustand bestehen grundsätzlich immer noch beide Pole aus Blei, allerdings wurden dem jetzt vierfach geladenen Pb<sup>4+</sup> beim Laden zwei Elektronen genommen, die es jetzt gerne wiederhaben möchte. Es holt sich daher beim Schliessen des Stromkreises von einem Bleiatom wieder zwei Elektronen, sodass es wieder zu einem stabilen, zweifach geladenen Pb<sup>2+</sup>-Ion wird. |
| − | Reduktionsreaktion: | + | Reduktionsreaktion beim Ladevorgang: |
:Pb<sup>2+</sup>SO<sub>4</sub><sup>2-</sup> + 2 e<sup>-</sup> → Pb<sup>0</sup> + SO<sub>4</sub><sup>2-</sup> | :Pb<sup>2+</sup>SO<sub>4</sub><sup>2-</sup> + 2 e<sup>-</sup> → Pb<sup>0</sup> + SO<sub>4</sub><sup>2-</sup> | ||
| − | Oxidationsreaktion: | + | Oxidationsreaktion beim Ladevorgang: |
:Pb<sup>2+</sup>SO<sub>4</sub><sup>2-</sup> + 2 H<sub>2</sub>O - 2 e<sup>-</sup> → Pb<sup>4+</sup>(O<sup>2-</sup>)<sub>2</sub> + SO<sub>4</sub><sup>2-</sup> + 4 H<sup>+</sup> | :Pb<sup>2+</sup>SO<sub>4</sub><sup>2-</sup> + 2 H<sub>2</sub>O - 2 e<sup>-</sup> → Pb<sup>4+</sup>(O<sup>2-</sup>)<sub>2</sub> + SO<sub>4</sub><sup>2-</sup> + 4 H<sup>+</sup> | ||
| Zeile 219: | Zeile 219: | ||
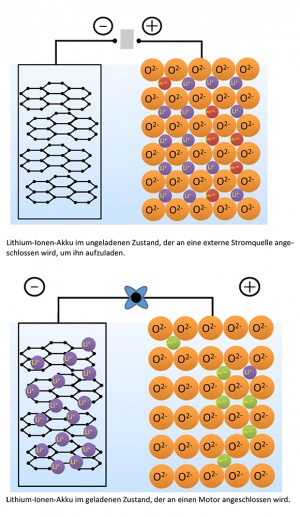
[[image:Lithium-Ionen-Akku.jpg|thumb|right|Prinzip des Lithium-Ionen-Akkus]] | [[image:Lithium-Ionen-Akku.jpg|thumb|right|Prinzip des Lithium-Ionen-Akkus]] | ||
| − | Lithium-Ionen-Akkus sind der Standard für heutige Handy-, Tablet-, Laptop- und Kameraakkus und haben die Zink-Kohle-Batterie abgelöst. Ihr Preis ist in den letzten Jahren stark gesunken, sodass der Preis in diesen | + | Lithium-Ionen-Akkus sind der Standard für heutige Handy-, Tablet-, Laptop- und Kameraakkus und haben die Zink-Kohle-Batterie und die Nickel-Cadmium- und Metallhydrid-Akkus abgelöst. Ihr Preis ist in den letzten Jahren stark gesunken, sodass der Preis in diesen Bereichen keine Rolle mehr spielt. Dabei spielen zwei Faktoren im Vergleich zwischen Zink und Lithium eine grosse Rolle: |
| − | * Das Gewicht von Lithium ist | + | * Das Gewicht von Lithium ist im Bezug auf die Energiedichte wesentlich geringer als das von Zink: Die Dichte von Lithium ist mit ~0.534g/cm<sup>3</sup> deutlich kleiner als die von Zink mit ~7.14g/cm<sup>3</sup>. |
| − | * Die Kapazität, die mit Lithium erreicht werden kann, ist bedeutend grösser als die mit Zink erreichbare: Das Redoxpotenzial von Lithium ist mit -3.03V sehr viel grösser als das von Zink mit -0.76V. Lithium gibt viel | + | * Die Kapazität, die mit Lithium erreicht werden kann, ist bedeutend grösser als die mit Zink erreichbare: Das Redoxpotenzial von Lithium ist mit -3.03V sehr viel grösser als das von Zink mit -0.76V. Lithium gibt viel leichter seine Elektronen ab als Zink. |
==== Reaktionsgleichung ==== | ==== Reaktionsgleichung ==== | ||
| Zeile 235: | Zeile 235: | ||
* Den Akku aber einmal pro Monat trotzdem vollständig entladen: Da der Überladungs- und Tiefentladungs-Schutz von der Kapazität des Akkus abhängt, werden viele Ladegeräte automatisch kalibriert, wenn ein Akku entladen wird, bis sich das Gerät von selbst ausschaltet. Das sollte etwa einmal pro Monat geschehen. | * Den Akku aber einmal pro Monat trotzdem vollständig entladen: Da der Überladungs- und Tiefentladungs-Schutz von der Kapazität des Akkus abhängt, werden viele Ladegeräte automatisch kalibriert, wenn ein Akku entladen wird, bis sich das Gerät von selbst ausschaltet. Das sollte etwa einmal pro Monat geschehen. | ||
| − | ==== | + | ==== Anforderungen an die Reproduzierbarkeit der chemischen Reaktionen bei Akkus ==== |
Berechnung der Anzahl Tage, nach der ein Akku 80% seiner ursprünglichen Kapazität erreicht, wenn seine Kapazität sich mit jedem Tag mit je einem Ladezyklus um 1% verschlechtert: | Berechnung der Anzahl Tage, nach der ein Akku 80% seiner ursprünglichen Kapazität erreicht, wenn seine Kapazität sich mit jedem Tag mit je einem Ladezyklus um 1% verschlechtert: | ||
| Zeile 247: | Zeile 247: | ||
:x ≈ 0.9998 | :x ≈ 0.9998 | ||
:100 - (~0.9998 × 100) ≈ 0.02% | :100 - (~0.9998 × 100) ≈ 0.02% | ||
| − | :→ Der Kapazitätsverlust pro Ladezyklus beträgt ~0.02% | + | :→ Der Kapazitätsverlust pro Ladezyklus beträgt ~0.02% der vorherigen Kapazität; diese fällt somit in Form einer Hyperbel ab |
== Quellen == | == Quellen == | ||
* Unterrichtseinheit ''Mobile Energiequellen'' | * Unterrichtseinheit ''Mobile Energiequellen'' | ||
* Chemieunterricht bei Herrn Deuber | * Chemieunterricht bei Herrn Deuber | ||
Aktuelle Version vom 9. August 2016, 20:49 Uhr
Inhaltsverzeichnis
- 1 Funktionsweise einer Batterie
- 2 Beispiele von Batterietypen als Knopfzellen
- 3 Akkumulatoren
- 4 Quellen
Funktionsweise einer Batterie
Das Grundprinzip einer Batterie basiert darauf, dass Elektronen aufgrund von Redox-Reaktionen zu wandern beginnen, also von einem Ort an einen anderen zu fliessen. Das liegt daran, dass der Oxidator Elektronen stärker anzieht als der Reduktor.
Beim Verbrennen von Aluminiumpulver gehen Elektronen vom Aluminium zum Sauerstoff über. Das ist eine exotherme Redox-Reaktion, bei der natürlich Energie freigesetzt wird. Nur ist diese Energie so nicht nutzbar. Wie kann man also nun dieses Prinzip nutzen, um daraus elektrischen Strom zu erzeugen?
Die Idee ist, die Elektronen, die bei der Reaktion umverteilt werden, nicht direkt zum Empfänger (auch Oxidator) fliessen zu lassen, sondern sie (zum Beispiel über die Batteriepole) umzuleiten. Dazu müssen die Oxidationsreaktion und die Reduktionsreaktion getrennt werden. Sie dürfen aber nicht vollständig getrennt werden, denn die Ladungen, die beim Elektronentransport entstehen, müssen ausgeglichen werden können. Sonst kommt der Transport zum Erliegen.
Beispiel der Funktionsweise einer Batterie an der Alu-Luft-Zelle
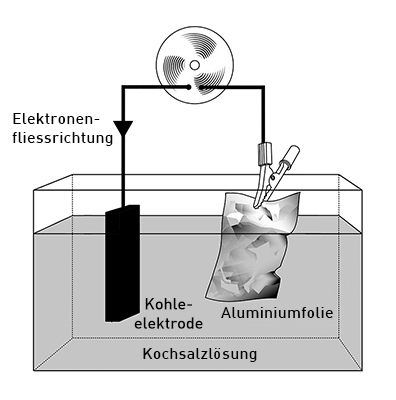
Wichtig für diesen und andere Batterietypen ist, dass Elektronen Nichtschwimmer sind. Das heisst, sie können nicht in Wasser transportiert werden, auch wenn das Wasser gelöste Salze enthält. Dafür verantwortlich, dass in Salzwasser elektrischer Strom geleitet wird, sind nicht die Elektronen, sondern die gelösten Ionen, die dabei chemisch verändert werden.
Füllt man eine Schale mit einer Kochsalzlösung und taucht sowohl eine Aluminiumfolie als auch eine Kohleelektrode, die beide miteinander über einen Verbraucher verbunden sind, in die Flüssigkeit, so erhält man einen Elektronenfluss von der Aluminiumfolie zur Kohleelektrode. Dieses Prinzip funktioniert, weil die Al3+- und die O2+-Ionen durch die Kochsalzlösung ausgeglichen werden können. Würde man die beiden Elektroden in einzelne Gefässe tauchen oder sie gar einfach an der Luft lassen, so gäbe es für die Ionen keinen Weg, zu wandern und die Ladung wieder auszugleichen. Ausserdem lösen die Chlorid-Ionen aus der Lösung die Aluminium-Schutzschicht auf.
Aufbau und Funktionen der verschiedenen Bestandteile
- Die Kohleelektrode links stellt den Katalysator für die Reduktion dar.
- Die Alufolie rechts stellt den Reduktor dar, bei dem die Oxidation stattfindet.
- Der Drehmotor oben stellt den Verbraucher dar, durch den die Elektronen von rechts nach links hindurchfliessen.
- Die Kochsalzlösung unten stellt die ionenpermeable Trennung zwischen den Elektroden dar, durch die der Ladungsausgleich erfolgt. Es löst sich die Al2O3-Schutzschicht auf.
Reaktion und Elektronenfluss
Die Oxidation lautet:
- Al + 3 OH- → Al(OH)3 + 3 e-
Die Reduktion lautet:
- O2 + 2 H2O + 4 e- → 4 OH-
Die gesamte Redox-Reaktion lautet:
- 4 Al + 3 O2 + 6 H2O → 4 Al(OH)3
Aluminium befindet sich in der dritten Hauptgruppe des Periodensystems und hält seine Elektronen nicht so stark wie Sauerstoff, der sich rechts davon in der vierten Hauptgruppe befindet. Somit fliessen die Elektronen vom Aluminium zum Sauerstoff.
Ladungsausgleich durch Separator
Wie oben schon erwähnt, können Elektronen nicht durch Wasser transportiert werden; auch nicht durch eine Kochsalzlösung. Sie sind somit gezwungen, den längeren und beschwerlicheren Weg über den Verbraucher zu nehmen. Das tun sie aber trotzdem gerne, weil sie von Sauerstoff stärker angezogen werden als von Aluminium. Weil sich die negative Ladung aber nun zum Oxidator verschiebt, folgen die entstandenen positiv geladenen Ionen (hier: Al3+-Ionen) über den kürzeren Weg, die Kochsalzlösung.
Ladung, Spannung, Stromstärke, Leistung, Energiegehalt
| Grösse | Symbol | Einheit | Beschreibung und Zusammenhänge |
|---|---|---|---|
| Ladung | Q | Coulomb [C] | Ein Coulomb entspricht der Ladung von etwas mehr als einem Mikromol Elektronen. Ladungen werden oft als Ampèrestunden angegeben. |
| Spannung | U | Volt [V] | Die Spannung ist ein Mass für die Energie, die ein Elektron transportiert und ist vom Reduktor und dem Oxidator abhängig. Sie kann durch eine serielle Schaltung erhöht werden. |
| Stromstärke | I | Ampère [A] | Ein Ampère entspricht dem Fluss von einem Coulomb pro Sekunde. Die Stromstärke kann durch eine Parallel-Schaltung erhöht werden. |
| Leistung | P | Watt [W] | Je grösser die Spannung und die Stromstärke sind, desto grösser ist auch die Leistung: P = U × I |
| Energiegehalt | W / E | Joule [J] | Für die Variable W, die leicht mit der Einheit W für Watt verwechselt werden kann, benutzt man deshalb auch oft E. |
- Enthält Inhalte aus der Tabelle auf Seite 29 im Skript Mobile Energiequellen
Berechnung der Spannung (Vergleich mit Wasserstoff)
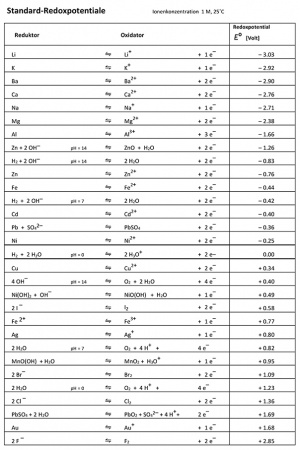
Wie oben in der Tabelle zu lesen, ist die Spannung ein Mass für die Energie, die ein Elektron transportiert. Sie ist von Reduktor (wo die Oxidation stattfindet) und dem Oxidator (wo die Reduktion stattfindet) abhängig. Je nachdem, wie stark diese die Elektronen anziehen, variiert auch die Spannung zwischen den beiden. Man kann also sagen, die Spannung zeigt den Unterschied der Tendenz der beiden Elektroden, Elektronen anzuziehen.
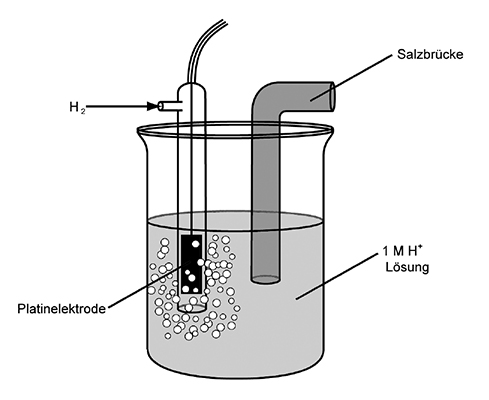
Um die sogenannten Redoxpotenziale tabellarisch darstellen zu können, hat man sich auf einen Referenzstoff mittleren Redoxpotenzials geeinigt, nämlich Wassertoff (H). Da die zu messenden Stoffe nach Abgabe von Elektronen wieder bereit sind, neue Elektronen aufzunehmen, nimmt man für Lithium Li/Li+, bei Fluor F2/F- und beim der Standardwasserstoffhalbzelle Wasserstoff H2/H+. Also immer das jeweilige Redoxpaar.
Eine Messeinheit, die aus zwei Gefässen mit den beiden Redox-Paaren besteht, die für den Ladungsausgleich durch eine Salzbrücke miteinander verbunden sind, nennt man Zelle; ein einzelnes Gefäss heisst somit Halbzelle. Die Standardhalbzelle mit dem Referenzstoff Wasserstoff sieht folgendermassen aus:
- Durch den Glaskolben wird gasförmiger Wasserstoff geblasen
- Die weiter unten hängende Platinelektrode wird vom Wasserstoff umspült
- Eine Salzbrücke dient zur Ionenwanderung
- Das Ganze taucht in einer einmolaren H+-Lösung
Durch das Verbinden der Standardhalbzelle mit allen anderen Halbzellen kann die entstehende Spannung gemessen und in eine Tabelle eingetragen werden. Mit diesen Werten kann dann die Spannung zwischen zwei beliebigen Redox-Partnern ungefähr berechnet werden. Natürlich kann es in der Realität zu kleineren Abweichungen kommen.
- Standard-Zellspannung = RedoxpotenzialOxidator - RedoxpotenzialReduktor
Um mit dieser Tabelle besser arbeiten zu können, kann man sich folgende Regeln merken:
- Oben links sind die starken Reduktoren und unten rechts die starken Oxidatoren.
- Befindet sich der Reduktor in der Tabelle weiter oben als der Oxidator, so findet ein Elektronenfluss statt.
- Befindet sich der Reduktor in der Tabelle weiter unten als der Oxidator, so findet kein Elektronenfluss statt.
- Je stärker das Gefälle von Reduktor (oben links) zum Oxidator (unten rechts) ist, desto höher ist die Spannung.
Beispiele von Batterietypen als Knopfzellen
Knopfzellen
Anwendungsbereiche
Knopfzellen werden in vielen verschiedenen elektronischen Geräten mit verschiedenen Anforderungen eingesetzt. Beispiele für Geräte mit tiefem Strombedarf etwa sind kleinere Wecker, Armbanduhren, Waagen, Drahtloskopfhörer oder auch Musikgratulationskarten. Knopfzellen können aber ihre Anwendung auch in Geräten mit hohen Ansprüchen auf Verlässlichkeit wie zum Beispiel Herzschrittmachern finden. Für eine Liste von Batterie- und Anwendungstypen siehe: Beispiele von Batterietypen
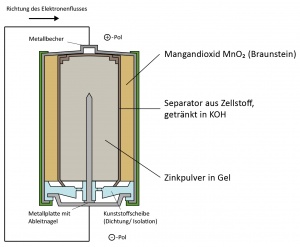
Alkali-Mangan-Zelle
Funktion, Reaktionsgleichung
Die Funktion der Alkali-Mangan-Zelle ähnelt der der Alu-Luft-Batterie; sie hat jedoch andere Inhaltsstoffe: Statt Sauerstoff dient hier Mangandioxid (MnO2), auch Braunstein genannt, als Oxidator. In einem Gel verteiltes Zinkpulver, das mehr Oberfläche als Feststoff hat und, anders als Aluminium, keine undurchdringliche Oxidschicht bildet, übernimmt die Arbeit der Aluminium-Folie und somit die des Reduktors. Ein Separator aus Zellstoff, getränkt in KOH und durchlässig für Zink- und Hydroxid-Ionen, ersetzt die Kochsalzlösung. Er sorgt dafür, dass ein Ladungsausgleich stattfinden kann, die Elektronen aber trotzdem den Weg durch den Stromverbraucher nehmen müssen.
Reduktionsreaktion:
- MnO2 + e- + H2O → MnOOH + OH-
Oxidationsreaktion:
- Zn + 4 OH- → [Zn2+(OH-)4]2- + 2 e-
Redox-Reaktion:
- 2 MnO2 + Zn + 2 H2O + OH- → 2 MnOOH + [Zn2+(OH-)4]2-
Vor- und Nachteile, Anwendungsbereiche und Vorteile gegenüber der Kohle-Zink-Zelle
Die Alkali-Mangan-Batterie ist die heutzutage weltweit meistverbreitete Batterie. Sie ist billig und man stellt an sie keine hohen Qualitätsanforderungen. Ihre Spannung nimmt nämlich während des Betriebs kontinuiertlich ab. Ihre Energiedichte ist mittelmässig, die Kapazität aber gering. Man verwendet sie somit für Spielzeuge oder Billiguhren.
Berechnete Spannung:
- (0.95V) - (-0.76V) = 1.71V
Abnahme der Spannung über Zeit von Knopfzellen
Die Leistungsfähigkeit von Kohle-Zink-Batterien nimmt wesentlich schneller ab als die von Alkali-Mangan-Batterien. In beiden Typen befinden sich Zn2+-Ionen. Dass die Leistungsfähigkeit abnimmt, liegt daran, dass die Zn2+-Ionen in Kohle-Zink-Batterien mit Cl--Ionen, die vom Ammoniumchlorid als Elektrolyt zugegeben werden, einen festen Niederschlag bilden, während die Zn2+-Ionen in Alkali-Mangan-Batterien lange gelöst bleiben. Durch den Niederschlag nimmt die Ionenwanderung ab und mit ihr der Ladungsausgleich, was die Leistungsfähigkeit dann schnell sinken lässt. Noch dazu diffundieren die Zn2+-Ionen infolge dessen langsamer vom Minuspol weg: Die Rückreaktion steigt und die Leistungsfähigkeit sinkt noch tiefer.
Alu-Luft-Batterie
Reaktionsgleichung
Reduktionsreaktion:
- O2 + 2 H2O + 4 e- → 4 OH-
Oxidationsreaktion:
- Al + 3 OH- → Al(OH)3 + 3 e-
Redox-Reaktion:
- 4 Al + 3 O2 + 6 H2O → 4 Al(OH)3
Vor- und Nachteile, Anwendungsbereiche
Die Alu-Luft-Batterie hat zwar eine hohe Energiedichte, ist aber wegen der relativ dazu hohen Betriebskosten nicht weit verbreitet.
Ursprüngliche Spannung: 1.2V
Silberoxid-Zink-Zelle
Reaktionsgleichung
Redox-Reaktion:
- Zn + Ag2O → ZnO + 2 Ag
Vor- und Nachteile, Anwendungsbereiche
Die Spannung der Silberoxid-Zink-Batterie bleibt bis zum Schluss ziemlich konstant, bis sie dann abrupt abfällt. Ihre Kapazität und Energiedichte sind mittelmässig gross. Das Problem ist der hohe Silberpreis, der die Batterie eher teuer macht. Trotzdem eignet sie sich aufgrund ihrer eher höheren Qualität gut für teure Uhren oder Ähnliches.
Ursprüngliche Spannung:
- (0.8V) - (-1.26V) = 2.06V
Zink-Luft-Zelle
Reaktionsgleichung
Redox-Reaktion:
- 2 Zn + O2 → 2 ZnO
Vor- und Nachteile, Anwendungsbereiche
Die Zink-Luft-Batterie hat sowohl eine grosse Energiedichte als auch eine hohe Kapazität. Sie ist nicht allzu teuer in der Produktion, dafür benötigt sie aber kontinuierlich Sauerstoff von aussen und eine konstante Luftfeuchtigkeit. Als Batterie eines Hörgeräts zum Beispiel ist sie daher gut geeignet.
Ursprüngliche Spannung:
- (0.40V) - (-1.26V) = 1.66V
(Achtung: Überspannung wegen O2 → OH-; Oxidator O2 von aussen)
Lithium-Mangan-Zelle
Reaktionsgleichung
Redox-Reaktion: 2 Li + 2 MnO2 + 2 H2O → 2 Li + 2 MnOOH + 2 OH-
Vor- und Nachteile, Anwendungsbereiche
Die Kapazität der Lithium-Mangan-Batterie hält sich im Rahmen, ihre Energiedichte ist aber aufgrund der hohen Spannung sehr gross. Der minimale Abfall der Spannung über Zeit der Benutzung ist vernachlässigbar. Bei zu hoher Spannung kann sich aus dem Wasser aber Wasserstoff bilden, das sich natürlich aufgrund der geringeren Dichte von Gasen[1] ausdehnt und die Batterie zum Platzen und somit zum Auslaufen bringen kann. Zusammen mit dem Sauerstoff von aussen bildet Wasserstoff dann ein Knallgas und wird so gefährlich. Zum Glück wird bei der Herstellung von Batterien dieses Typs stark darauf geachtet, dass das nicht passieren kann. Geeignet sind sie vor allem für teurere Geräte wie Fotoapparate oder solche mit militärischer Anwendung.
Siehe auch: Konkurrenz-Reaktionen
Ursprüngliche Spannung:
- (0.95V) - (-3.03V) = 3.98V
Konkurrenz-Reaktionen
Damit sich in einer Batterie die Ionen für den Ladungsausgleich bewegen können, müssen sie in einem polaren Lösungsmittel gelöst sein. Normalerweise ist das Wasser. Das Sauerstoffatom in H2O hat mit den beiden H-Atomen zwar schon genug Elektronen. Bietet ein Reduktor seine Elektronen aber so schön an, nimmt das Sauerstoffatom lieber ein vom Reduktor kommendes Elektron auf, statt sich eines in einer Elektronenpaarbindung mit einem Wasserstoffatom zu teilen. Wenn das Redoxpotenzial der Reaktion nicht allzu gross ist, dann ist der Vorgang zwar spontan, aber glücklicherweise sehr oft kinetisch gehemmt, da die Aktivierungsenergie sehr gross ist. Dadurch wird die Reaktion so langsam, dass sie eigentlich nicht mehr abläuft. Bei Lithium ist das hingegen anders: Hier ist das Valenzelektron so schwach gebunden, dass das leicht zu einem Verhängnis werden kann. Lithium-Ionen-Batterien beinhalten deshalb andere polare Lösungsmittel als Wasser.
Akkumulatoren
Im Unterschied zu den Primärbatterien, die oben behandelt werden, können Akkumulatoren (besser bekannt als Akkus) wieder aufgeladen werden. Für die längste Lebenszeit empfiehlt sich der im Abschnitt Haltbarkeit von Akkus beschriebene Umgang mit ihnen.
Beispiel der Funktionsweise am Blei-Akku
Bleiakkus sind vor allem als Starterbatterien in Fahrzeugen bekannt. Sie weisen einen erstaunlich langsamen Alterungsprozess auf. Das liegt vor allem daran, dass sowohl die positive als auch die negative Elektrode aus Blei bestehen und allgemein gilt immer: Weniger verschiedene Elemente heisst weniger Möglichkeiten für ungewollte Reaktionen.
Funktion, Reaktionsgleichung
Im entladenen Zustand besteht sowohl der negative als auch der positive Pol aus Bleisulfat-Salz (Pb2+SO42-). Im geladenen Zustand bestehen grundsätzlich immer noch beide Pole aus Blei, allerdings wurden dem jetzt vierfach geladenen Pb4+ beim Laden zwei Elektronen genommen, die es jetzt gerne wiederhaben möchte. Es holt sich daher beim Schliessen des Stromkreises von einem Bleiatom wieder zwei Elektronen, sodass es wieder zu einem stabilen, zweifach geladenen Pb2+-Ion wird.
Reduktionsreaktion beim Ladevorgang:
- Pb2+SO42- + 2 e- → Pb0 + SO42-
Oxidationsreaktion beim Ladevorgang:
- Pb2+SO42- + 2 H2O - 2 e- → Pb4+(O2-)2 + SO42- + 4 H+
Gesamte Redox-Reaktion beim Entladungsvorgang
- Pb + Pb4+(O2-)2 + 2 H2SO4 → 2 Pb2+SO42- + 2 H2O
Lithium-Ionen-Akku
Lithium-Ionen-Akkus sind der Standard für heutige Handy-, Tablet-, Laptop- und Kameraakkus und haben die Zink-Kohle-Batterie und die Nickel-Cadmium- und Metallhydrid-Akkus abgelöst. Ihr Preis ist in den letzten Jahren stark gesunken, sodass der Preis in diesen Bereichen keine Rolle mehr spielt. Dabei spielen zwei Faktoren im Vergleich zwischen Zink und Lithium eine grosse Rolle:
- Das Gewicht von Lithium ist im Bezug auf die Energiedichte wesentlich geringer als das von Zink: Die Dichte von Lithium ist mit ~0.534g/cm3 deutlich kleiner als die von Zink mit ~7.14g/cm3.
- Die Kapazität, die mit Lithium erreicht werden kann, ist bedeutend grösser als die mit Zink erreichbare: Das Redoxpotenzial von Lithium ist mit -3.03V sehr viel grösser als das von Zink mit -0.76V. Lithium gibt viel leichter seine Elektronen ab als Zink.
Reaktionsgleichung
Redox-Reaktion: 2 Li + 2 MnO2 + 2 H2O → 2 Li + 2 MnOOH + 2 OH-
Haltbarkeit von Akkus
Um aus einem Akku die beste Leistung und die längste Lebensdauer herauszuholen, sollte man folgende Punkte beachten:
- Das richtige Ladegerät benutzen: Sowohl bei älteren Metallhydrid-Akkus als auch bei neueren Lithium-Ionen-Akkus sollte man das mitgelieferte oder ein baugleiches Ladegerät verwenden, denn bei vielen Akkus sind mehrere Zellen auf unterschiedliche Weise miteinander verbunden. Auch der Punkt der Überladung und der der Tiefentladung (siehe nächster Punkt) könnte genauer erkannt werden.
- Den Akku im Normalfall nicht vollständig entladen: Eine vollständige Entladung verändert die Struktur der beteiligten Stoffe wesentlich stärker als eine Teilentladung. Das Ammenmärchen des Memory-Effekts ist bei Lithium-Ionen-Akkus schlichtweg nicht wahr und taucht auch bei den älteren Nickel-Cadmium-Akkus nur dann auf, wenn der Akku viele Male bis zum genau gleichen Zustand entladen wird.
- Den Akku aber einmal pro Monat trotzdem vollständig entladen: Da der Überladungs- und Tiefentladungs-Schutz von der Kapazität des Akkus abhängt, werden viele Ladegeräte automatisch kalibriert, wenn ein Akku entladen wird, bis sich das Gerät von selbst ausschaltet. Das sollte etwa einmal pro Monat geschehen.
Anforderungen an die Reproduzierbarkeit der chemischen Reaktionen bei Akkus
Berechnung der Anzahl Tage, nach der ein Akku 80% seiner ursprünglichen Kapazität erreicht, wenn seine Kapazität sich mit jedem Tag mit je einem Ladezyklus um 1% verschlechtert:
- 80% = 0.8 | Zielkapazität
- (100% - 1%) = 99% = 0.99 | Kapazitätverschlechterung pro Tag
- 0.99x = 0.8 → log0.99(0.8) = x ≈ 22.203
- → Der Akku erreicht diesen Zustand nach etwa 22 Tagen
Berechnung des Kapazitätsverlusts pro Ladezyklus eines Akkus, der nach 1000 Ladezyklen noch genau 80% seiner ursprünglichen Kapazität aufweist.
- x1000 = 0.8 | 1000. Wurzel ziehen
- x ≈ 0.9998
- 100 - (~0.9998 × 100) ≈ 0.02%
- → Der Kapazitätsverlust pro Ladezyklus beträgt ~0.02% der vorherigen Kapazität; diese fällt somit in Form einer Hyperbel ab
Quellen
- Unterrichtseinheit Mobile Energiequellen
- Chemieunterricht bei Herrn Deuber