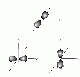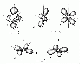Orbitale

Wie in der Unschärferelationstheorie von Werner Heisenberg (Das unfassbare Elektron) beschrieben, ist der genaue Aufenthaltsort eines Elektrons nicht genau bestimmbar. Elektronen können nicht nur als Teilchen sondern auch als Welle beschrieben werden (Welle-Teilchen-Dualismus). Aus der Schrödingergleichung, 1926 von Erwin Schrödinger hergeleitet, geht diese Wellenbeschreibung hervor. Mit der Schrödingergleichung kann man die möglichen Energieniveaus der Elektronen und die Wahrscheinlichkeit diese im Raum anzutreffen, berechnen. Durch diese Wahrscheinlichkeit kann jedem Elektron ein Raum definiert werden, indem es sich aufhält. Genau diese Räume nennt man Orbitale.
Inhaltsverzeichnis
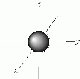
Formen
| Orbital | Form | Maximale Anzahl Orbitale | Maximale Anzahl Elektronen |
|---|---|---|---|
| s | Kugel | 1 | 2 |
| p | Hanteln | 3 | 6 |
| d | 4 Kreuzende Dopelhanteln, 1 Doppelschnuller |
5 | 10 |
| f | 4 Rosetten, 3 Doppelschnuller |
7 | 14 |
Spin
Frage aus dem Unterricht von R.D.: Wieso kann ein Orbital zwei Elektronen haben? Nach dem Coulombgesetz dürfte ein Orbital nur eines haben (Die negativen Ladunged der zwei Elektronen würden sich abstossen).
Drehende, geladene Körper erzeugen ein Magnetfeld. Man stelle sich das Elektron als geladenes Teilchen bzw. als Kugel vor. Diese Kugel hat 2 Drehachsen, im Uhrzeigersinn und im Gegenuhrzeigersinn. Diesen Drehachsen ist je einen Spinzustand (⌉ oder ⌊) zugeordnet. Elektronen mit gleichem Spinzustand stossen sich ab, solche mit unterschiedlichem Spinzustand ziehen sich an. Haben nun zwei Elektronen in einem Orbital verschiedene Spinzustände, kann die Abstoßung mit der magnetischen Anziehung überwunden werden.
| Spin | Reaktion | Spinzustand |
|---|---|---|
| gleich | Abstossung | (⌉, ⌈),(⌋, ⌊) |
| verschieden | Anziehung | (⌉, ⌊),(⌋, ⌈) |
Experiment Geisterstunde aka Fluoreszenz/Phosphoreszenz
Experiment: Zwei Flüssigkeiten werden im Dunkeln mit UV-Licht beleuchtet. Beide Flüssigkeiten leuchten. Das Licht wird abgestellt. Eine der beiden Flüssigkeiten leuchtet weiter.
- Fluoreszenz
- Durch das UV-Licht (Lichtenergie) können die Elektronen in ein höheres Energieniveau wechseln. Sie wechseln vom energetisch höchsten besetzten Orbital (HOMO, Abk. für Highest Occupied Molecular Orbital) zum energetisch niedrigsen unbesetzten Orbital (LUMO, Abk. für Lowest Unoccupied Molecular Orbital). Wenn es dann wieder in das ursprüngliche Orbital zurückspringt, wird Energie in Form von Licht abgegeben -> Leuchten. Da das Elektron durchschnittlich 10-8s im höheren Orbital verweilt, leuchtet der Stoff so lange wie es UV-Licht hat.
- Phosphoreszenz
- Auch hier befindet sich das Elektron nach der Anregung durch UV-Licht im nächsthöheren Orbital. Zusätzlich ändert es auch noch seinen Spinzustand (Spinflip). Wegen dem Pauli-Prinzip kann dieses Elektron nicht mehr in sein ursprüngliches Orbital zurück, denn es können nur zwei Elektronen in einem Orbital sein, welche verschiedene Spinzustände aufweisen. Durch Energieabgabe des angeregten Molekühls an ein anderes Teilchen bei einem Zusammenstoss ändert der Spinzustand aber wieder (Spinflip), und das Elektron kann in sein ursprüngliches Orbital zurück springen. Wie oben schon erwähnt, wird dadurch Lichtenergie abgegeben. Aufgrund des anderen Spinzustands sollten die Elektronen auch dann im höheren Orbital bleiben, wenn es kein UV-Licht mehr hat. Viele Elektronen springen also erst später wieder herunter. Dadurch leuchtet der Stoff auch dann noch, wenn er nicht mehr mit UV-Licht bestrahlt wird.
Quellen
Notizen aus dem Unterricht von R.D.
Wikipedia/Orbital [27.05.2010]
Bilder ([2]
Weblinks
Swisseduc ([3]) – Unterrichtsserver für Chemie
Mediawiki Hilfeseite ([4])