Löslichkeit
Bei der Löslichkeit handelt es sich um eine Eigenschaft eines Stoffes. Sie beschreibt ob und in welchem Umfang sich ein Reinstoff in einem Lösungsmittel löst. Bei dem Lösungsmittel handelt es sich meist um eine Flüssigkeit in der sich der Reinstoff unter homogenen (gleichen) Bedingungen lösen kann.
Inhaltsverzeichnis
Anwendungen der Löslichkeit
blablabla
Experiment
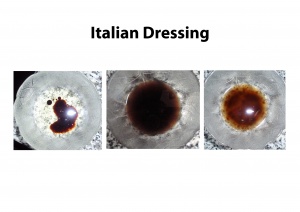
Was löst Wasser und was löst Pentan?
In der untenstehenden Tabelle, sowie den Bildern, sieht man wie sich gewisse Stoffe in Wasser und andere Stoffe in Pentan lösen. (Wasser und Pentan können sich nicht mischen). Die Stoffe, die sich in Wasser lösen sind hydrophile (wasserlöslich) Stoffe, die die sich in Pentan lösen sind lipophile (fettlöslich) Stoffe.
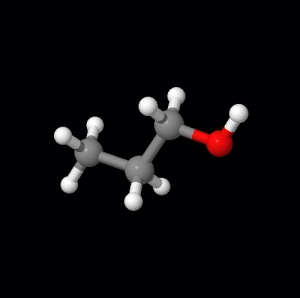
Erklärung: Betrachtet die Strukturen der Stoffe, lösen sich die Stoffe, die eine oder mehrere Wasserstoffbrücken besitzen, in Wasser (hydrophil), wenn keine Wasserstoffbrücken vorhanden sind, lösen die Stoffe sich in Pentan (lipophil). Es gibt auch viele Stoffe, die sich in polaren sowie in unpolaren Lösungsmittel lösen.
Beispiel hierfür Propanol.
Löslichkeit
Die qualitative Löslichkeit beschreibt, ob ein gewisser Feststoff mit einer Flüssigkeit gut löslich ist. Genauer gesagt bestimmen die molekularen Eigenschaften des Stoffes sowie die, der Flüssigkeit ob sich ein Reinstoff in einer gewissen Flüssigkeit löst. Wir kommen zu der Frage: Was löst was? - Die mittelalterlichen Alchemisten stellten dafür den Merksatz "Similia Similibus solvuntur" auf. Zu Deutsch: Ähnliches wird von Ähnlichem gelöst. Da sie bemerkten, dass polare Stoffe (Die polare Bindung) in polaren Lösungsmitteln gut löslich, in unpolaren Lösungsmittel aber schlecht löslich sind. Bei unpolaren Stoffen wiederum gilt, dass sie in unpolaren Lösungsmitteln (z.B. Pentan) gut, in polaren aber schlecht löslich sind. Wir unterscheiden somit zwischen hydrophilen (polaren) und lipophilen (unpolaren) Stoffen: - hydrophile Stoffe (z.B.: Salze --> Ionengitter(Bildung des Ionengitters)) lösen in wasserartigen Flüssigkeiten, sprich in polaren Lösungsmitteln. - lipophile Stoffe (z.B.: wachsartige und fettige Stoffe) lösen in Flüssigkeiten wie Benzin, sprich in unpolaren Lösungsmitteln bzw. organischen Lösungsmitteln. Man unterscheidet zwar zwischen diesen beiden Punkten, jedoch muss man auch erwähnen, dass es sehr viele Stoffe gibt, die sich sowohl in einem polaren sowie auch in einem unpolaren Lösungsmittel lösen.
Strukturbetrachtung (ZMK)
Betrachtet man die Struktur der hydrophilen, lipophilen und deren Stoffe die beides sind, so ist ein
unterschied erkennbar. Wie bereits angesprochen spielen die „OH“-Gruppen eine entscheidende Rolle.
Wiederum nützlich für die Erkennung eines hydrophilen oder lipophilen Stoffes sind die
Zwischenmolekulare Kräfte. (ZMK)
• Sind die Anziehungskräfte innerhalb des Moleküls stark, so handelt es sich um eine hydrophile
Struktur.
• Sind die Anziehungskräfte innerhalb des Moleküls schwach, so handelt es sich um eine lipophile
Struktur.
• Sind die Anziehungskräfte innerhalb des Moleküls „mittel“, so ist der Stoff in einer hydrophilen
sowie in einer lipophilen Lösung löslich.
hydrophil, lipophil oder gar beides?
• Ein Stoff ist hydrophil, wenn es an den Enden des Moleküls nur
„OH“-Atome gibt.
• Ein Stoff ist lipophil, wenn der Stoff an keinem Ende „OH“-besetzt
ist.
• Ein Stoff ist hydrophil sowohl auch lipophil, wenn er am einen Ende
eine „OH“-Besetzung hat und am anderen Ende keine „OH“-Besetzung
hat. (Lösungsvermittler-Prinzip)
Quellen
• Chemieunterlagen des 1. und 2. Jahres an der Kantonsschule Baden • Bilder wurden von den Autoren selbst erstellt und bearbeitet mit Aussnahme von "Propanolstruktur"
Weblinks
- Löslichkeit Wikipedia (http://de.wikipedia.org/wiki/Löslichkeit/)
- Lenntech (http://www.lenntech.com/deutsch/Element-und-Wasser/Loeslichkeit.htm)
- Hier findet man ein virtuelles Propanol Molekül
(http://www.bioc.uzh.ch/bipweb/lexikon/metaboliten/npropanol/npropanol.html)
bearbeitet und verfasst von Mike Bertschinger und Andrea Talarico