Metalle und Nichtmetalle
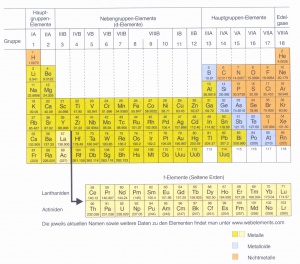
Das Periodensystem ist in drei Bereiche gegliedert. Die grösste Gruppe nimmt die der Metalle ein, die sich auf der linken Seite befindet. Daneben befinden sich die Halbmetalle, ganz rechts im Periodensystem sind die Nichtmetalle. Die Übergänge sind jeweils fliessend. Die Unterteilung in die verschiedenen Bereiche kommt durch das Kriterium des Coulombgesetzes zustande:
Auf das Periodensystem bezogen heisst dies:
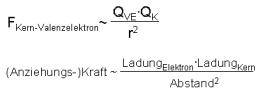
- Umso mehr Schalen ein Atom hat, umso kleiner wird die Kraft F. Obwohl die Ladung zwar zunimmt im Kern, da mehr Protonen dazu kommen, denn der Abstand des Kerns zu den Valenzelektronen ist entscheidend.
- Umso mehr Elektronen ein Atom hat, umso grösser wird die Kraft F. Der Abstand des Kerns zu den Valenzelektronen bleibt gleich, zusätzlich kommen noch mehr Protonen dazu, was zur Folge hat, dass die Ladung im Kern grösser wird und somit auch die der Kraft F.
Metalle haben generell eine schwache Kraft FKern-VE. Caesium hat hiermit die schwächsten Anziehungskräfte - ist ein "Schwächling". Als Schwächling haben sie die Tendenz Elektronen zu verlieren, womit sie die Opfer sind.
Die Nichtmetalle weisen eine starke FKern-VE auf. Helium hat hier die stärksten Anziehungskräfte - ist somit ein "Kraftprotz". Ihre Tendenz ist die Aufnahme von Valenzelektronen, sie sind die Täter. Trifft ein "Kraftprotz", dessen Valenzschale noch nicht voll ist, auf ein "Schwächling", kann es sein, dass er die Elektronen des "Schwächlings" klaut.
Inhaltsverzeichnis
Metalle
Die ersten Metalle wurden 7000 v. Chr. entdeckt. Sie waren für die Menschheit von grosser Bedeutung. Sogar zwei Zeitalter wurden nach ihnen Benannt; Bronzezeit und Eisenzeitalter.
Metalle kommen in der Natur nur in Verbindungen (Ionenform)vor. Nur die Edelmetalle nicht, zu ihnen gehören Gold, Silber, Platin und Kupfer. Lässt man die Metalle (ausser die Edelmetalle) in der freien Natur stehen, oxidieren sie schnell (Bsp.: Eisen rostet). Bei diesem Vorgang werden eben die Elektronen durch den Sauerstoff geklaut.
Eigenschaften der Metalle
Metalle ordnen sich nicht wie Salze in einem Gitter an. Da sie relativ wenig Valenzelektronen besitzen und ihre Ionisierungsenergie im Vergleich zu den Nichtmetallen kleiner ist, sind sie nicht fähig Moleküle oder somit Gitter (Vergleich Ionengitter) zu bilden. Vielmehr bilden sie Metallgitter, bei denen sich freibewegliche Elektronen ausserhalb der positiv geladenen Atomrümpfe befinden.

- elektrisch leitfähig
- Durch die freibeweglichen Elektronen zwischen den Atomrümpfen
- gute Wärmeleitfähigkeit
- Die Schwingungen werden schnell weitergegeben, da die Einheiten so dicht gepackt sind.
- Glanz
- Durch die freibeweglichen Elektronen können sie in allen Farben vorkommen bzw. spiegeln. Sie nehmen alle Farben auf und geben es wieder ab.
- Verformbarkeit
- Keine festen Ebenen der Struktur. Freibewegliche Elektronen wirken wie Kitt (Gleitmittel).
- hohe Dichte
- Struktur hat nur eine Einheit, wodurch diese sehr dicht aneinander angeordnet werden können.
Gruppen

- Alkalimetalle gehören zu der 1. Hauptgruppe des Periodensystems und weisen genau ein Valenzelektion auf. Zu ihrer Guppe gehören Litium, Natrium, Kalium, Rubidium, Caesium und Francium. Sie gehören zu den Leichtmetallen und lassen sich sogar problemlos schneiden. Durch ihre geringe Dichte können sie auf dem Wasser schwimmen. Gibt man Natrium ins Wasser löst es sich unter Funkensprühen auf. Kalium entflammt sich sogar, wobei Litium hingegen sich ohne Nebenerscheinungen auflöst.
- Da sie schnell mit der Luft reagieren werden sie in Flüssigkeit unter Luftverschluss aufbewahrt.
- Ausnahme: Wasserstoff gehört nicht zu dieser Gruppe, obwohl es sich in der gleichen Spalte des Periodensystems ist! Wegen seiner Struktur gehört es dort hin, jedoch gibt es kein Elektion ab - es ist also ein Nichtmetall. Innerhalb der Nichtmetalle ist es jedoch widerum zu schwach, um Elektronen aufzunehmen (ist also schon fast ein Halbmetall). Es weist schwache Anziehungskräfte zu seinem einzigen Elektron auf und ist in Metallen löslich.
- Erdalkalimetalle gehören zu der 2. Hauptgruppe und weisen zwei Valenzelektronen auf. Beryllium, Magnesium, Calcium, Strontium, Barium und Radium gehören zu dieser Gruppe. Ihre Eigenschaften sind ähnlich zu denen der Alkalimetalle. Da sie jedoch zwei Valenzelektronen besitzen sind sie etwas schlechter in Wasser löslich, jedoch immer noch gut.
- Auch sie werden luftdicht in Flüssigkeit aufbewahrt. In der Natur kommen sie im Boden in Verbindungen vor. Bsp.: Ca2+Co32- = Gips
Legierungen
Legierungen nennt man die Verbindungen von mindestens zwei Metallen. Bei der Verbindung entstehen meistens ganz andere Eigenschaften des neuen Produktes. So ist beispielsweise der Chromstahl nicht-rostend, was natürlich für uns in von Vorteil ist. Wir verwenden daher fast keine reinen Metalle, da die Legierungen "bessere" Eigenschaften aufweisen. Nur für die elektrischen Leitungen benützt man sie, da sie eine höhere elektrische Leitfähigkeit aufweisen.
Beispiele für Legierungen:
- Chromstahl: nicht-rostend, Fe + Cr
- Nickelstahl: gehärteter Stahl, Fe + Ni
- Federstahl: hart und biegsam, Si + Cr
Nichtmetalle

Sie haben die Tendenz die Elektronen von anderen Elementen (Metallen) zu klauen, um ihre Valenzschale zu füllen und so wie Edelgase 8 Valenzelektronen haben. Nichtmetalle weisen nicht die charakterischen Eigenschaften der Metalle auf. Beispielsweise haben sie meist nur eine geringe Leitfähigkeit der Wärme und der Elektrizität und sie weisen nicht den metallischen Glanz auf.
Im Gegensatz zu den Metallen, gehen sie negative Ionenbindungen ein.
Gruppen
- Halogene bezeichnet man auch mit dem Namen "Salzbildner". Bestehnd aus Fluor, Chlor, Brom, und Iod (und Astat) sind sie die erste reine Nichtmetall-Gruppe im Periodensystem. Gehen sie mit den Metallen eine Verbindung ein, entsteht ein Salz. Bsp: Kochsaltz NaCl
- Edelgase beseitzen 8 Valenzelektonen, können also kein weiteres Elekto mehr aufnehmen. Sie wurden erst spät in der Geschichte der Menschen entdeckt, da sie nicht sehr häufig sind, nicht reagieren und sie somit immer gasförmig sind, wodurch man sie nicht sehen kann. Da die Edelgase sich nicht verändern, haben sie diesen Namen bekommen. Zu der Gruppe gehören: Helium, Neon, Argon, Krypton, Xenon und Radon.
- Der Rest der Elemente ist zwar auch in Gruppen geteilt, jedoch besitzen diese nicht nur Metalle oder nur Nichtmetalle. Gegen rechts des Periodensystems werden die Gruppen immer "nichtmetallischer". D.h das schon ab der 3. Gruppe ein Halbmetall dazu kommt, bei der 2. sind es schon zwei Halbmetalle und ein Nichtmetall,...etc.
Bindungen

- Metall - Metall = Metallbindung
- Bsp.: Legierungen wie Chromstahl Fe + Cr
- Nichtmetall - Nichtmetall = Elektronenpaarbindung
- Bsp.: Kohlendioxid CO2
- Metall und ein Nichtmetall = Ionenbindung
- Bsp.: Eisenoxid Fe203
Halbmetalle

Die kleine Gruppe der Halbmetalle hat Eigenschaften der Metalle, wie auch der Nichtmetalle. So hat beispielsweise Silicium den metallischen Glanz, leitet jedoch die Elektroziät bei Normaltemperatur nicht gut.
Zu der Gruppe der Halbmetalle gehören folgende Elemente:
| B | Bor | typisches Halbmetall |
| Si | Silicium | typisches Halbmetall |
| Ge | Germanium | ist eher ein Metall |
| As | Arsen | typisches Halbmetall |
| Se | Selen | ist eher ein Nichtmetall |
| Sb | Antimon | ist eher ein Metall |
| Te | Tellur | typisches Halbmetall |
| Po | Polonium | ist eher ein Metall |
| At | Astat | ist eher ein Nichtmetall |
Viele der Halbmetalle sind Halbleiter. Das heisst, das sie bei zunehmener Temperatur die Leitfähigkeit des elekt. Stroms zunimmt.
Quellen
- Chemieunterlagen