Experimentelle Hinweise
[Also de hr. deuber het gxeit:so muess klar werde, wieso die ionisierungsenergie so wechtig esch,(zodem hani no chli html i baut, mer chönd denn das no perfektioniere, wenn mer mal alli informatione komplett hend) also:]
In der Chemie spielen die Elektronen, die sich in der Elektronenhülle befinden, eine zentrale Rolle. Die wichtigen Abläufe bei chemischen Reaktionen passieren in der Elektronenhülle. Es ist daher elementar zu wissen, wie genau die Elektronenhülle aufgebaut ist, resp. wo sich die Elektronen befinden.
In diesem Abschnitt soll durch die unterschiedlichen Ionisierungsenergien der Atome bewiesen werden, wie genau die Elektronenhülle aufgebaut ist.
Bei a) werden wir auf die 1. Ionisierungsenergien von den einzelnen Atomen eingehen.
Bei b) betrachten wir bei einem Atom die 1., 2., 3., ... und n. Ionsierungsenergie. .
Inhaltsverzeichnis
Ionisierungsenergie
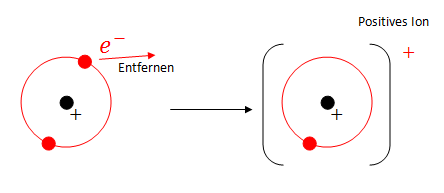
Die Ionisierungsenergie gibt an, wie viel Energie benötigt wird, um ein Elektron von einem Atom zu trennen.
a) 1. Ionisierungsenergie gemäss Ordnungszahl
(Spalte im Periodensystem)
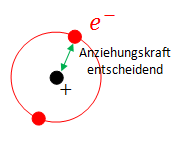
Die 1. Ionisierungsenergie hängt von der Anziehungskraft zwischen Atomkern und dem äussersten Elektron, welches man dem Atom entfernen will, ab.
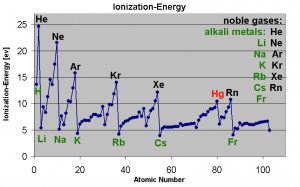
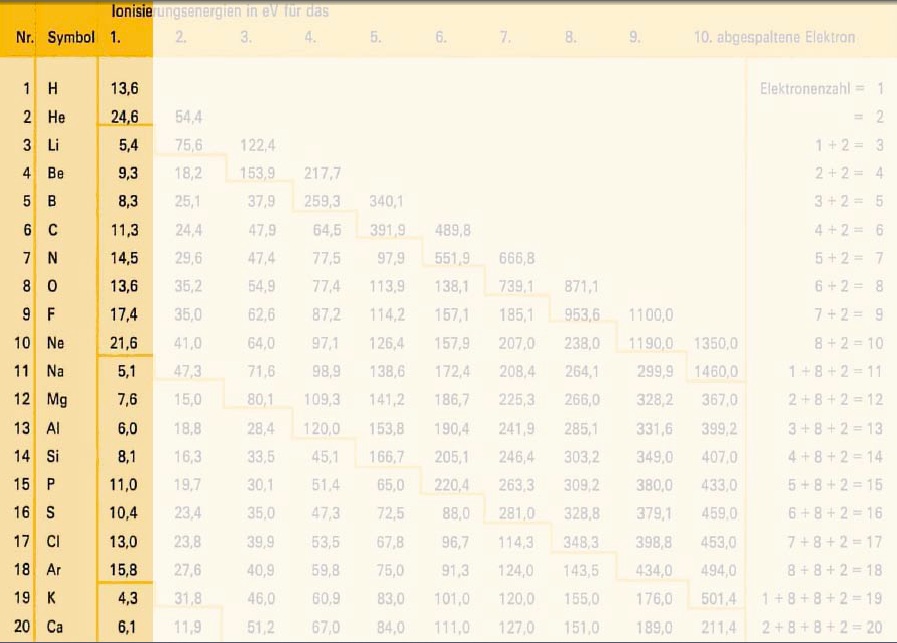
Um die 1. Ionisierungsenergie gemäss Ordnungszahl zu veranschaulichen, betrachten wir die Ionisierungsenergien der ersten drei Atome im Periodensystem.
Es gibt 3 Dinge zu beachten:
a) In der Grafik sieht man, dass von Wasserstoff zu Helium die Ionisierungsenergie etwa um das doppelte zu nimmt. Das liegt daran, dass von Wasserstoff zu Helium ein Proton und ein Elektron hinzu kommen. Somit werden die Elektronen vom Kern etwa doppelt so stark angezogen und es wird etwa doppelt so viel Energie gebraucht um ein Elektron zu entfernen.
Im ersten Fall geht es also darum, dass beim Entfernen die Elektronen näher zusammenrücken, was zu einer stärkeren Anziehung zwischen Kern und Elektronen führt (siehe Coulomb-Gesetz unten).
b) Von Helium zu Lithium nimmt die Ionisierungsenergie ab, obwohl wiederum ein Elektron und ein Proton hinzugekommen sind. Das heisst, es wird plötzlich weniger Energie gebraucht um das äusserste Elektron dem Atom zu entziehen.
Das kein eigentlich nur so erklärt werden, dass das Elektron plötzlich viel weiter entfernt ist -> neue Hauptschale
c) Betrachten wir uns nun in der neuen Hauptschale z.B. die Atome Beryllium und Bor. Von Beryllium zu Bor müsste die Ionisierungsenergie wieder zunehmen, da ja ein weiteres Proton/Elektron dazu kommt.
Diese plötzliche, leichte Abnahme ist darauf zurück zu führen, dass wir auch die Unterschalen betrachten müssen. Wenn sie ein bisschen runterscrollen, sehen sie unsere Übersicht der Schalen. Wenn eine neue Unterschale entsteht, zeigt sich das in einer leichten Abnahme der Ionisierungsenergie!
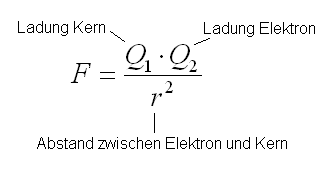
Vom Coulomb Gesetz wissen wir, dass die Anziehungskraft proportional zum Abstand im quadrat ist.
Daher kann das nur so erklärt werden, dass das Elektron plötzlich viel weiter entfernt ist.
b) Ionisierungsenergien eines einzelnen Atoms (einer Zeile)
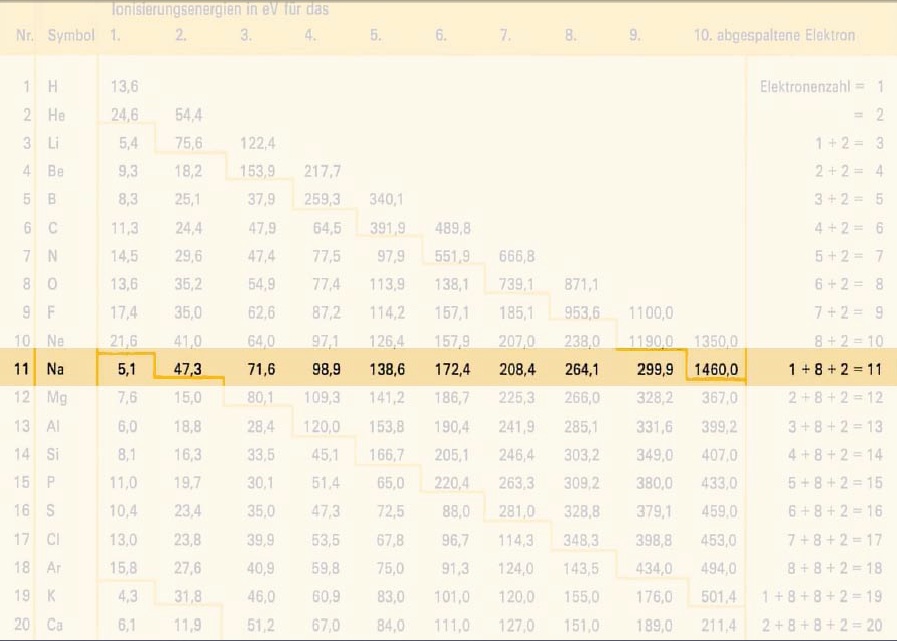 - Durch Entfernen eines Elektrons kommen die anderen Elektronen näher und die Anziehung zwischen den nähergekommenen Elektronen und dem Kern wird stärker (Aufgrund des Coulomb-Gesetzes siehe oben).
- Die Ladung der Elektronen und des Kerns bleibt aber gleich, obwohl sich die Ladung des ganzen Atoms natürlich schon verändert (wird positiv).
- Durch Entfernen eines Elektrons kommen die anderen Elektronen näher und die Anziehung zwischen den nähergekommenen Elektronen und dem Kern wird stärker (Aufgrund des Coulomb-Gesetzes siehe oben).
- Die Ladung der Elektronen und des Kerns bleibt aber gleich, obwohl sich die Ladung des ganzen Atoms natürlich schon verändert (wird positiv).
z.B. Bei Natrium, muss das zweite Elektron 10mal näher sein, da es viel stärker angezogen wird.
Noch 2 wichtige Hinweise: 1) Jedes weitere Element besitzt 1 Proton mehr! ->Kerne werden nicht müde! D.h. Der Kern zieht die Elektronen nicht stärker an, wenn weniger Elektronen vorhanden sind. Es spielt also keine Rolle, ob ein Atom drei oder 10 Elektronen anziehen muss.
2) Abstand muss konstant sein (ich weiss ned genau wien ich das söll erkläre… du scho?)
Schlussfolgerungen
Bei a) haben wir die Gesamtheit aller Atome betrachtet und gesehen(anhand der Ionisierungsenergie), dass von Helium zu Lithium das 3. Elektron plötzlich viel weiter enfernt ist. Das Elektron hat eine neue Schale angefangen. Die Elektronenhülle ist Quantisiert (Schalenförmig aufgebaut).)
Bei b) haben wir uns ein einzelnes Atom angesehen und untersucht, was beim Entfernen passiert bzw. was die Folgen sind. Entfernt man ein Elektron, rücken die Anderen näher Richtung Kern und die Ionisierungsenergie um weitere Elektronen zu entfernen wird grösser(da näher und somit stärker vom Kern angezogen). Daraus folgt: → Die elektronen Hülle ist schalenartig aufgebaut!!
Struktur der Elektronenhülle
| Schale | Nr. | Unterschalen | Ne- (max)=2n2 | |||
| s | p | d | f | |||
| K | 1 | 2 | 2 | |||
| L | 2 | 2 | 6 | 8 | ||
| M | 3 | 2 | 6 | 10 | 18 | |
| N | 4 | 2 | 6 | 10 | 14 | 32 |
| O | 5 | 2 | 6 | 10 | 14 | 50 |
| P | 6 | 2 | 6 | 10 | 14 | 72 |
| Q | 7 | 2 | 6 | 10 | 14 | 98 |
Quellen
Ionisierungsenergie http://de.wikipedia.org/wiki/Ionisierungsenergie
Notizen aus dem Unterricht
Grafik Ionisierungsenergien http://de.academic.ru/pictures/dewiki/73/IonizationEnergyAtomicWeight.PNG