Grundlagen der Ionenbindung
Die Ionenbindung(siehe auch Bildung des Ionengitters) entsteht durch die Anziehungskraft zweier unterschiedlich geladener Ionen. Wenn Atome Elektronen aufnehmen oder abgeben, entstehen Ionen. Kationen sind Ionen mit positiver Ladung (aus der Valenzschale wurden Elektronen abgegeben). Anionen sind negativ geladen (in die Valenzschale wurden Elektronen aufgenommen). Die Ionenbindung tritt zwischen Metallen und Nichtmetallen (siehe Metalle und Nichtmetalle) auf. Metalle haben die Tendenz zur Elektronenabgabe, Nichtmetalle die Tendenz zur Elektronenaufnahme. Alle Feststoffe, die aus Ionen aufgebaut sind, werden als Salze (Eigenschaften von Salzen) bezeichnet.
Inhaltsverzeichnis
Aufbau eines Ions
Ein Ion besteht aus einem oder mehreren Atomen und hat eine elektrische Ladung.
Eine Ionenbindung entsteht immer zwischen einem Metall und einem Nichtmetall.
Sie treten vor allem zwischen Elementen mit hoher Elektronegativitätsdifferenz auf. (Elemente mit ähnlichen Elektronegativitäten gehen bevorzugt kovalente Bindungen ein.) ![Beispiele für Ionenbindung und kovalente Bindung[(Quelle: http://www2.chemie.uni-erlangen.de/projects/vsc/chemie-mediziner-neu/bindung/ionenbindung.html)]](/chemiewiki/images/8/8f/Ionenbindung_kovalente_Bindung.jpg)
Die Ladung eines Ions
Alle Stoffe haben das Bestreben Edelgaskonfiguration zu erreichen. Bei der Ionenbindung gibt das Metall Elektronen ab und das Nichtmetall nimmt sie auf. Die Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe von Elektronen aus der Valenzschale erzielt. Achtung: Bei der Ladungsverschiebung ändert sich die Kernladungszahl nicht!
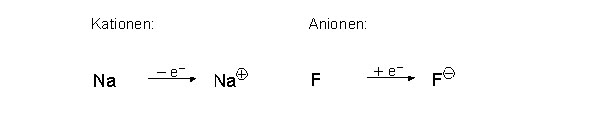
Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, so genannte Ionen:
Positiv geladenen Ionen, so genannte Kationen
Negativ geladenen Ionen, so genannte Anionen
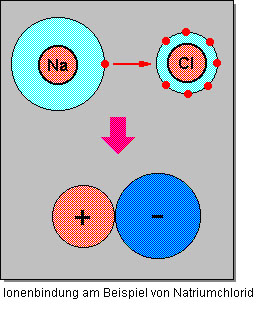
Meistens sind Kationen und Anionen einfach (Na+ bzw. Cl -), zweifach (Mg 2+ bzw. O2-) oder dreifach (Al3+ bzw. N3-) positiv respektive negativ geladen. Beispielsweise ein zweifach geladenes Kation zieht die Anionen in der Umgebung doppelt so stark an, wie ein einfach geladenes Kation. Generell sind Anionen immer grösser als Kationen, da bei der Elektronenaufnahme das Teilchen grösser wird, respektive das Kation durch die Elektronenabgabe kleiner wird.
Durch die unterschiedliche Ladung ziehen sich die beiden Ionen gegenseitig an und lagern sich zu einer Verbindung zusammen. Dieses Zusammenlagern nennt man Ionenbindung.
Die Ionenbindung
Bei einer Ionenbindung wirken zwischen den entgegengesetzt geladenen Ionen elektrostatische Anziehungskräfte, so genannte Coulomb’sche Kräfte. Nach dem coulomb’schen Gesetz ist die Anziehungskraft zwischen zwei elektrischen Ladungen
1. von der Größe der Ladungen
2. vom Abstand zwischen den Ladungen abhängig.
Da die gegenseitige Anziehung in alle Richtungen gleich stark wirkt, umlagern sich entgegengesetzt geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein so genanntes Ionengitter (ein Kristall) mit der typischen Gitterstruktur. Das Ionengitter (Bildung des Ionengitters) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit.
Quellen
- Chemieunterlagen
Weblinks
- Uni Erlangen - Ionenbindungen und kovalente Bindungen
- Uniterra - Natriumchlorid