Das Prinzip des Energieminimums
Inhaltsverzeichnis
"Die Natur strebt energiearme Zustände an."
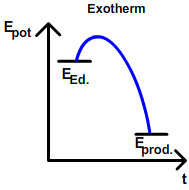
Dies bedeutet, dass exotherme Reaktionen von der Natur bevorzugt werden (eine Reaktion ist exotherm, wenn die Produkte energieärmer sind als die Edukte).
Die Energie kommt in der Chemie als Ekin oder Epot vor. Wie auch in der Physik, ist Epot eine abgespeicherte Energieform, die, falls möglich, entladen werden will. Dies ist der Fall, wenn die Reaktionsenthalpie ΔH<0 ist. (Um zu erfahren, wie man die Reaktionsenthalpie abschätzt, hier klicken.)
Vermutung
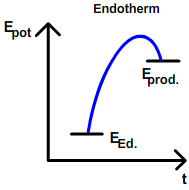
- endotherme Reaktionen laufen von selbst ab,
- exotherme nicht.
Die Vermutung, dass nur Reaktionen von selbst ablaufen (=spontane Reaktion) , bei denen es warm wird, stimmt jedoch nicht. (Dies haben wir im Unterricht bei Herrn Deuber am eigenen Leib erfahren, als er uns Aceton auf die Arme gespritzt hat und es dabei sehr kalt wurde. Es fand eine Reaktion "von selbst" statt.) Das Prinzip des Energieminimums alleine kann deshalb nicht entscheiden, ob eine Reaktion von selbst abläuft oder nicht. Es wird ein zweites Prinzip benötigt:
Das Prinzip des Entropiemaximums
Da die Spontanität einer Reaktion nun von zwei Faktoren abhängt und diese jeweils aussagen, ob der Vorgang bei gegebenen Bedingungen günstig oder ungünstig ist, haben wir zwei mal zwei, also vier Typen chemischer Reaktionen.
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie