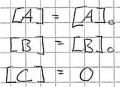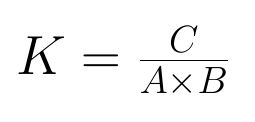Die Beschreibung des Chemischen Gleichgewichts
Gleichgewicht bedeutet nicht, dass die chemische Aktivität aufgehört hat, sondern nur, dass Hin- und Rückreaktionen mit derselben Geschwindigkeit ablaufen, sodass sich die Mengen von Reaktand und Produkt nicht mehr ändern.
Inhaltsverzeichnis
Einführung
Am besten ist es wohl anhand folgendem Beispiel des Holzapfelkrieges zu verstehen
Man stelle sich einen Holzapfelbaum vor, der auf der Grenzlinie zwischen zwei Gärten steht; in dem einen wohnt eine alte Frau und in dem anderen ein Vater, der seinem Sohn aufgetragen hat, hinauszugehen und den Garten von Holzäpfeln zu reinigen. Der Junge merkt schnell, dass man die Holzäpfel am einfachsten dadurch los wird, wenn man sie in den Nachbargarten wirft. Er tut es und erregt den Zorn der alten Frau. Jetzt beginnen der Junge und die Frau Holzäpfel hin und her, über den Zaun, zu werfen so schnell sie können. Wer wird gewinnen? Die Schlacht läuft in drei Phasen ab. Wenn man annimmt, dass der Junge stärker und schneller ist als die alte Frau, könnte man meinen, dass der Konflikt damit endet, dass alle Äpfel auf der Seite der alten Frau landen . Wenn sich auf beiden Seiten des Zauns die gleiche Anzahl von Äpfeln befindet, ist es zwar richtig, dass der Junge die Äpfel schneller über den Zaun werfen wird, als sie die alte Frau zurückwerfen kann. Aber das heißt nur, dass mehr Äpfel auf der Seite der alten Frau sein werden, die dann leichter zu erreichen sind. Auf der Seite des Jungen werden sie rarer, und der Junge muss mehr herumrennen, um sie aufzuheben. Schließlich wird ein Gleichstand oder ein Gleichgewicht erreicht, in dem die gleiche Anzahl der Äpfel in beiden Richtungen über den Zaun fliegen. Die alten Frau wirft weniger schnell, hat aber geringere Mühe, Äpfel zu finden; der Junge wirft schneller, verliert aber Zeit dadurch, dass er herumrennt und die wenigen Äpfel auf seiner Seite sucht. Das Verhältnis der Äpfel auf den beiden Seiten des Zauns wird schließlich durch die relative Geschwindigkeit der beiden Kämpfer bestimmt, doch werden nicht alle Äpfel auf einer Seite landen.[1]
Die Phasen des "Krieges"
- 1. Phase
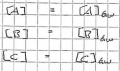
Bei Beginn, Zeitpunkt 0, gibt es noch keine Produkte und die Edukte sind noch vollzählig.
- 2. Phase
Die Reaktion beginnt, das Produkt wird aus den kleiner werdeden Edukten gebildet.
- 3. Phase
Nun ist das Gleichgewicht erreicht und die Menge der Produkte wie auch der Edukte bleiben gleich, solange nicht etwas anderes das Gleichgewicht stört.
Grundstruktur der Formel
Edukte A und B werden zum Produkt C bis das chemische Gleichgewicht erreicht wird.
A + B ⇌ C
Die Gleigewichtskonstante
Die Gleichgewichtskonstante K ergibt sich aus dem Division von den Produkten durch die Edukte und gibt Auskunft von welcher Seite mehr vorhanden ist. ( Auf welcher Seite das Gleichgewicht ist.)
K strebt gegen unendlich, wenn fast alle Edukte zu Produkte reagiert haben (Hinreaktion). Somit hat die Konstante K einen Wert von (deutlich)>1. Gibt es nun fast nur Edukte, liegt das GW auf der „linken“ Seite und K ist <1.
Zusammenfassung Simple Club
Die Bedeutung des chemischen Gleichgewichts wird am Anfang dieses Video mithilfe eines Beispiels einer einfachen Matherechnung erklärt. Anschließend werden die Verhältnisse der Edukte und der Produkte im Gleichgewicht verdeutlicht. Später kommt man auch auf die Gleichgewichtskonstante K zu sprechen. Dies wird durch ein Beispiel erklärt, in dem eine Reaktion mit den Produkten a und b zu den Edukten c und d reagieren. Hier wird erklärt wie die Hin- und Rückreaktion ausgerechnet werden.
Merke:
- Das chemische Gleichgewicht entsteht bei einer Reaktion bei der nach einer gewissen Zeit die Stoffe, welche als Edukte vorliegen und die Stoffe die als Produkte vorliegen, in einem bestimmten Mengenverhältnis vorliegen.
- Bei einem chemischen Gleichgewicht sind Hin- sowie Rückreaktion gleich schnell.
- Im Unterricht haben wir uns grundsätzlich mit den Bereichen
- K > 1, K < 1 und K = 1 befasst.
- Wenn die Gleichgewichtskonstante (Kc) kleiner als 1 ist, dann liegt das Gleichgewicht auf der linken Seite, also auf der Seite mit den Edukten und wenn es grösser als 1 ist, liegt es auf der rechte Seite, also auf der Seite mit den Produkten.
- Die Gleichgewichtskonstante ist eine Zahl die durch die Division der Konzentration der Produkte und der Konzentration der Edukte entsteht.
- Diese Zahl sagt aus, ob sich das Gleichgewicht schliesslich auf der Seite mit den Edukten oder auf der Seite mit den Produkten befindet.
- Besonders nützlich: Das Video ist einerseits nützlich, um die genauen Grenzwerte der Gleichgewichtskonstante zu verstehen. Andererseits wird der Zusammenhang zwischen der Gleichgewichtskonstante mit der Frage, ob eine Reaktion stattfindet oder nicht, verdeutlicht.
Quellen
- Eigene Notizen
Weblinks
- Holzapfelkrieg - Mittlerweile Offline
- Simple Club Video