Metalle und Nichtmetalle
Inhaltsverzeichnis
Charakter von Metallen und Nichtmetallen
Metalle und Nichtmetalle: Einleitung
Das Periodensystem besteht aus 118 Elementen und ist in drei Elementarten gegliedert. Die meisten Elemente gehören den Metallen an und befinden sich im Periodensystem auf der linken Seite. Ganz rechts befinden sich die Nichtmetalle. Beide Arten werden durch die Halbmetalle, die dazwischen liegen, verbunden. Der Unterschied zwischen den metallischen und nichtmetallischen Elementen spielt eine besonders wichtige Rolle bei der Einordnung der Eigenschaften und dem Reaktionsverhalten der Elemente.
Eigenschaften
Metallische Elemente weisen auf der stofflichen Ebene im Gegensatz zu nichtmetallischen Elementen bestimmte Eigenschaften auf. Diese sind:
- Metallischer Glanz
- Hohe elektrische Leitfähigkeit
- Hohe Wärmeleitfähigkeit
- Hohe Verformbarkeit
Genauere Erklärungen zu den Eigenschaften findest Du hier.
Reaktionsverhalten
Ein Atom, das seine Valenzelektronen stark bindet und noch Platz in seiner Valenzschale aufweist, kann einem Atom mit schwächeren Bindungskräften die Valenzelektronen entreissen. Der metallische oder nichtmetallische Charakter eines Elements bestimmt, ob es eher dazu neigt, in einer Reaktion Elektronen aufzunehmen oder abzugeben. Metallische Elemente haben die Tendenz Elektronen abzugeben, nichtmetallische Elemente nehmen eher Elektronen auf. Elektronegativität ist ein quantitativer Ausdruck für diese Tendenz. Ist sie hoch, will das Element Elektronen aufnehmen und umgekehrt.
Die Coulombkraft
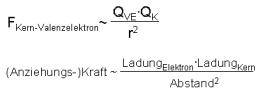
Die Ursache für die Unterschiede der Eigenschaften und des Reaktionsverhaltens der einzelnen Elemente liegt in der Struktur der Atome, besser gesagt in der Anziehungskraft, mit der ein Atomkern seine Valenzelektronen anzieht. Schon kleine Unterschiede in diesen Anziehungskräften können grosse Unterschiede von Stoffeigenschaften (Energiegehalt, Schmelz- und Siedepunkt, chemische Reaktivität) zur Folge haben. Diese Anziehungskraft, mit der Atome ihre Valenzelektronen anziehen wird durch das Coulombgesetz (Coulombkraft) beschrieben:
F ~ <mfrac>Q1*Q2 r2</mfrac>
oder
FKern-Valenzelektron ~ <mfrac>QVE*QK r2</mfrac>
Die Anziehungskraft zwischen einem Atomkern und seinem Valenzelektron entspricht also dem Produkt der Ladung des Valenzelektrons und der abgeschirmten Ladung (siehe nächsten Abschnitt Einflussfaktoren) des Kerns geteilt durch das Quadrat des Atomradius.
Um die Coulombkraft eines Atoms zu bestimmen, müssen drei wichtige Einflussfaktoren berücksichtigt werden:
- Kernladungszahl
Die Kernladungszahl bestimmt sowohl die Kernladung als auch die Menge der Elektronen in der Atomhülle.
- Atomradius
Der Atomradius bestimmt den Abstand zwischen dem Atomkern und der Atomhülle mit den äusseren (Valenz-) Elektronen des Atoms.
- Abschirmung
Die Anziehungskraft (Coulombkraft) wird ausserdem davon beeinflusst, wie viele Elektronen sich zwischen dem Kern und den Valenzelektronen in der Atomhülle befinden. Dies liegt daran, dass die Abstossung zwischen den Valenzelektronen und den inneren Elektronen die Anziehungskraft zwischen dem Atomkern und den Valenzelektronen abschwächt. Diesen Effekt nennt man Abschirmung.
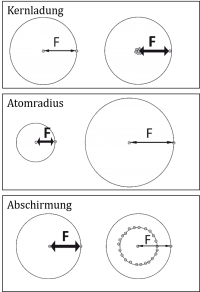
Einfluss der Einflussfaktoren auf die Anziehungskraft (Coulombkraft)
- Kernladungszahl
Je grösser die Kernladungszahl, desto grösser ist die Anziehungskraft.
- Atomradius
Je grösser der Atomradius (Abstand zwischen Kern und Elektron) desto kleiner ist die Anziehungskraft
- Abschirmung
Je grösser die Abschirmung durch innere Elektronenschalen, desto kleiner ist die Anziehungskraft.
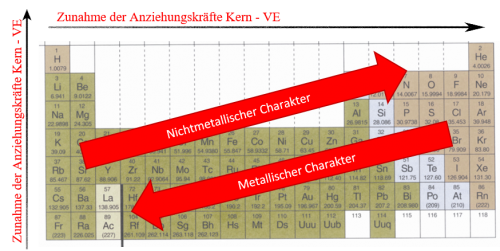
Die Coulombkraft im Periodensystem – Systematische Veränderung der Anziehungskräfte
Veränderung innerhalb einer Periode von links nach rechts:
Je weiter nach rechts im Periodensystem desto:
- Höher die Kernladungszahl (Zunahme) → Zunahme der Anziehungskraft (günstig)
- Tiefer der Atomradius (Abnahme) → Zunahme der Anziehungskraft (günstig)
- Keine Änderung der Abschirmung → Keine Auswirkung auf Anziehungskraft (neutral)
Eindeutige Situation durch zwei günstige
und einen neutralen Faktor für die Zunahme der Anziehungskräfte:
Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Periode von links nach rechts zu!
Veränderung innerhalb einer Gruppe von unten nach oben:
Je weiter nach oben im Periodensystem desto:
- Tiefer die Kernladungszahl (Abnahme) → Abnahme der Anziehungskraft (ungünstig)
- Tiefer der Atomradius (Abnahme) → Zunahme der Anziehungskraft (günstig)
- Abnahme der Abschirmung → Zunahme der Anziehungskraft (günstig)
Nicht ganz eindeutige Situation durch zwei günstige Faktoren für die Zunahme der Anziehungskräfte, jedoch einen ungünstigen Faktor, der eher für die Abnahme der Anziehungskräfte spricht. Aufgrund der Überzahl der günstigen Faktoren kann jedoch vermutet werden, dass eine Zunahme der Anziehungskraft stattfindet:
Die Anziehungskraft zwischen Kern und Valenzelektronen nimmt innerhalb einer Gruppe von unten nach oben zu!
Elektronendiebe und Elektronenopfer
Elektronenopfer sind Elemente, die aufgrund ihrer eher schwachen Anziehungskraft zwischen dem Kern und den Valenzelektronen bei einem Kontakt mit einem anderen Stoff tendenziell eher Elektronen abgeben. → Metalle sind Elektronenopfer.
Elektronendiebe sind Elemente, die aufgrund ihrer eher starken Anziehungskraft zwischen dem Kern und den Valenzelektronen bei einem Kontakt mit einem anderen Stoff tendenziell eher Elektronen aufnehmen. → Nichtmetalle sind Elektronendiebe.
Stärkster Elektronendieb
Zunahme der Anziehungskräfte innerhalb einer Periode von links nach rechts, und innerhalb einer Gruppe von unten nach oben: Also muss das Element ganz oben rechts der stärkste Elektronendieb sein. → Helium
Helium hat tatsächlich die stärksten Anziehungskräfte auf seine Valenzelektronen, ist aber ein Edelgas. Das bedeutet, dass seine Valenzschale voll ist. Ein weiteres aufgenommenes Elektron würde eine neue Schale mit bedeutend grösserem Radius und bedeutend schwächeren Anziehungskräften bedeuten. Edelgase sind deswegen weder Elektronenopfer noch Elektronendiebe.
Das Element, das sich am weitesten rechts oben befindet und zusätzlich noch Platz in seiner Valenzschale aufweist, also der stärkste Elektronendieb ist, ist Fluor.
Leichtestes Elektronenopfer
Abnahme der Anziehungskräfte innerhalb einer Periode von rechts nach links, und innerhalb einer Gruppe von oben nach unten: Also muss das Element ganz unten links das schwächste Elektronenopfer sein: Francium
Mehr Informationen
Metalle

Die ersten Metalle wurden 7000 v. Chr. entdeckt. Sie waren für die Menschheit von grosser Bedeutung zum Beispiel um Werkzeuge, Waffen oder Schmuck herzustellen. Sogar zwei Zeitalter wurden nach ihnen benannt; die Bronzezeit und die Eisenzeit. Metalle haben die Tendenz Elektronen abzugeben. Sie kommen in der Natur nur in Verbindungen mit Nichtmetallen (z.B. Erze, Salze) vor. Nur Edelmetalle, wie Gold, Silber, Platin und Kupfer sind als gediegene Metalle in der Natur zu finden. Lässt man Metalle (ausser Edelmetalle) an der freien Luft, oxidieren sie schnell (Bsp.: Eisen rostet). Dabei nimmt der Sauerstoff aus der Luft den Metallen Valenzelektronen.
Metallatome ordnen sich im elementaren, festen Zustand in Metallgittern an. Im Gegensatz zum Ionengitter bilden sie Metallbindungen, bei denen sich freibewegliche Elektronen ausserhalb der positiv geladenen Atomrümpfe befinden.
Wichtigste Metallgruppen im Periodensystem

- Alkalimetalle gehören zu der 1. Hauptgruppe∗ des Periodensystems und weisen genau ein Valenzelektron auf. Zu dieser Gruppe gehören Lithium, Natrium, Kalium, Rubidium, Caesium und Francium. Sie gehören zu den Leichtmetallen. Durch ihre geringe Dichte können sie auf dem Wasser schwimmen. Diese Metalle sind allgemein gut wasserlöslich. Ausserdem reagieren sie schnell mit dem Sauerstoff in der Luft, weswegen sie in einer Flüssigkeit unter Luftverschluss aufbewahrt werden.
Ausnahme: Wasserstoff gehört nicht zu den Alkalimetallen, obwohl es sich in der gleichen Gruppe des Periodensystems befindet! Es ist kein Metall, sondern ein Gas, gehört also zu den Nichtmetallen. Innerhalb der Nichtmetalle ist es zu schwach, um Elektronen aufzunehmen.
- Erdalkalimetalle gehören zu der 2. Hauptgruppe∗ und weisen zwei Valenzelektronen auf. Beryllium, Magnesium, Calcium, Strontium, Barium und Radium gehören zu dieser Gruppe. Ihre Eigenschaften sind ähnlich wie die der Alkalimetalle. Sie sind ähnlich gut in Wasser löslich. Auch sie werden luftdicht in Flüssigkeit aufbewahrt. In der Natur kommen sie im Boden in Verbindungen vor. Bsp.: Ca2+Co32- = Gips
∗Mehr zu den wichtigsten Hauptgruppen des Periodensystems findest du hier!
Legierungen
Legierungen nennt man die Verbindungen von mindestens zwei Metallen. Diese Metallverbindungen haben meist andere Eigenschaften als ihre Ursprungsmetalle, wie beispielsweise höhere Korrosionsbeständigkeit oder eine grössere Härte. Für die Industrie werden daher kaum reine Metalle verwendet, da ihre Legierungen grössere Vorteile bieten.
Ausnahme: Elektrische Leitungen: Reine Metalle werden oft für elektrische Leitungen verwendet, da sie eine höhere elektrische Leitfähigkeit aufweisen als die meisten Legierungen. Beispiele für Legierungen:
- Bronze: je nach Mischung gut verformbar, Cu + Sn
- Messing: meistens korrosionsbeständig, Cu + Zn
- Chromstahl: korrosionsbeständig, Fe + Cr
Nichtmetalle

Nichtmetalle haben die Tendenz Elektronen von anderen Elementen (Metallen) aufzunehmen, um ihre Valenzschale zu füllen. Nichtmetalle weisen nicht die charakteristischen Eigenschaften der Metalle auf. Im Gegensatz zu den Metallen gehen sie Ionenbindungen und Elektronenpaarbindungen ein.
Auf das Periodensystem bezogen heisst dies:
- Umso mehr Schalen ein Atom hat, umso kleiner wird die Kraft F. Obwohl die Ladung zwar zunimmt im Kern, da mehr Protonen dazu kommen, denn der Abstand des Kerns zu den Valenzelektronen ist entscheidend.
- Umso mehr Elektronen ein Atom hat, umso grösser wird die Kraft F. Der Abstand des Kerns zu den Valenzelektronen bleibt gleich, zusätzlich kommen noch mehr Protonen dazu, was zur Folge hat, dass die Ladung im Kern grösser wird und somit auch die der Kraft F.
Metalle haben generell eine schwache Kraft FKern-VE. Caesium hat hiermit die schwächsten Anziehungskräfte - ist ein "Schwächling". Als Schwächling haben sie die Tendenz Elektronen zu verlieren, womit sie die Opfer sind.
Die Nichtmetalle weisen eine starke FKern-VE auf. Helium hat hier die stärksten Anziehungskräfte - ist somit ein "Kraftprotz". Ihre Tendenz ist die Aufnahme von Valenzelektronen, sie sind die Täter. Trifft ein "Kraftprotz", dessen Valenzschale noch nicht voll ist, auf ein "Schwächling", kann es sein, dass er die Elektronen des "Schwächlings" klaut.
Metalle
Die ersten Metalle wurden 7000 v. Chr. entdeckt. Sie waren für die Menschheit von grosser Bedeutung. Sogar zwei Zeitalter wurden nach ihnen Benannt; Bronzezeit und Eisenzeitalter.
Metalle kommen in der Natur nur in Verbindungen (Ionenform)vor. Nur die Edelmetalle nicht, zu ihnen gehören Gold, Silber, Platin und Kupfer. Lässt man die Metalle (ausser die Edelmetalle) in der freien Natur stehen, oxidieren sie schnell (Bsp.: Eisen rostet). Bei diesem Vorgang werden eben die Elektronen durch den Sauerstoff geklaut.
Eigenschaften der Metalle
Metalle ordnen sich nicht wie Salze in einem Gitter an. Da sie relativ wenig Valenzelektronen besitzen und ihre Ionisierungsenergie im Vergleich zu den Nichtmetallen kleiner ist, sind sie nicht fähig Moleküle oder somit Gitter (Vergleich Ionengitter) zu bilden. Vielmehr bilden sie Metallgitter, bei denen sich freibewegliche Elektronen ausserhalb der positiv geladenen Atomrümpfe befinden.

- elektrisch leitfähig
- Durch die freibeweglichen Elektronen zwischen den Atomrümpfen
- gute Wärmeleitfähigkeit
- Die Schwingungen werden schnell weitergegeben, da die Einheiten so dicht gepackt sind.
- Glanz
- Durch die freibeweglichen Elektronen können sie in allen Farben vorkommen bzw. spiegeln. Sie nehmen alle Farben auf und geben es wieder ab.
- Verformbarkeit
- Keine festen Ebenen der Struktur. Freibewegliche Elektronen wirken wie Kitt (Gleitmittel).
- hohe Dichte
- Struktur hat nur eine Einheit, wodurch diese sehr dicht aneinander angeordnet werden können.
Gruppen

- Alkalimetalle gehören zu der 1. Hauptgruppe des Periodensystems und weisen genau ein Valenzelektion auf. Zu ihrer Guppe gehören Litium, Natrium, Kalium, Rubidium, Caesium und Francium. Sie gehören zu den Leichtmetallen und lassen sich sogar problemlos schneiden. Durch ihre geringe Dichte können sie auf dem Wasser schwimmen. Gibt man Natrium ins Wasser löst es sich unter Funkensprühen auf. Kalium entflammt sich sogar, wobei Litium hingegen sich ohne Nebenerscheinungen auflöst.
- Da sie schnell mit der Luft reagieren werden sie in Flüssigkeit unter Luftverschluss aufbewahrt.
- Ausnahme: Wasserstoff gehört nicht zu dieser Gruppe, obwohl es sich in der gleichen Spalte des Periodensystems ist! Wegen seiner Struktur gehört es dort hin, jedoch gibt es kein Elektion ab - es ist also ein Nichtmetall. Innerhalb der Nichtmetalle ist es jedoch widerum zu schwach, um Elektronen aufzunehmen (ist also schon fast ein Halbmetall). Es weist schwache Anziehungskräfte zu seinem einzigen Elektron auf und ist in Metallen löslich.
- Erdalkalimetalle gehören zu der 2. Hauptgruppe und weisen zwei Valenzelektronen auf. Beryllium, Magnesium, Calcium, Strontium, Barium und Radium gehören zu dieser Gruppe. Ihre Eigenschaften sind ähnlich zu denen der Alkalimetalle. Da sie jedoch zwei Valenzelektronen besitzen sind sie etwas schlechter in Wasser löslich, jedoch immer noch gut.
- Auch sie werden luftdicht in Flüssigkeit aufbewahrt. In der Natur kommen sie im Boden in Verbindungen vor. Bsp.: Ca2+Co32- = Gips
Legierungen
Legierungen nennt man die Verbindungen von mindestens zwei Metallen. Bei der Verbindung entstehen meistens ganz andere Eigenschaften des neuen Produktes. So ist beispielsweise der Chromstahl nicht-rostend, was natürlich für uns in von Vorteil ist. Wir verwenden daher fast keine reinen Metalle, da die Legierungen "bessere" Eigenschaften aufweisen. Nur für die elektrischen Leitungen benützt man sie, da sie eine höhere elektrische Leitfähigkeit aufweisen.
Beispiele für Legierungen:
- Chromstahl: nicht-rostend, Fe + Cr
- Nickelstahl: gehärteter Stahl, Fe + Ni
- Federstahl: hart und biegsam, Si + Cr
Nichtmetalle

Sie haben die Tendenz die Elektronen von anderen Elementen (Metallen) zu klauen, um ihre Valenzschale zu füllen und so wie Edelgase 8 Valenzelektronen haben. Nichtmetalle weisen nicht die charakterischen Eigenschaften der Metalle auf. Beispielsweise haben sie meist nur eine geringe Leitfähigkeit der Wärme und der Elektrizität und sie weisen nicht den metallischen Glanz auf.
Im Gegensatz zu den Metallen, gehen sie negative Ionenbindungen ein.
Gruppen
- Halogene bezeichnet man auch mit dem Namen "Salzbildner". Bestehnd aus Fluor, Chlor, Brom, und Iod (und Astat) sind sie die erste reine Nichtmetall-Gruppe im Periodensystem. Gehen sie mit den Metallen eine Verbindung ein, entsteht ein Salz. Bsp: Kochsaltz NaCl
- Edelgase beseitzen 8 Valenzelektonen, können also kein weiteres Elekto mehr aufnehmen. Sie wurden erst spät in der Geschichte der Menschen entdeckt, da sie nicht sehr häufig sind, nicht reagieren und sie somit immer gasförmig sind, wodurch man sie nicht sehen kann. Da die Edelgase sich nicht verändern, haben sie diesen Namen bekommen. Zu der Gruppe gehören: Helium, Neon, Argon, Krypton, Xenon und Radon.
- Der Rest der Elemente ist zwar auch in Gruppen geteilt, jedoch besitzen diese nicht nur Metalle oder nur Nichtmetalle. Gegen rechts des Periodensystems werden die Gruppen immer "nichtmetallischer". D.h das schon ab der 3. Gruppe ein Halbmetall dazu kommt, bei der 2. sind es schon zwei Halbmetalle und ein Nichtmetall,...etc.
Bindungen

- Metall - Metall = Metallbindung
- Bsp.: Legierungen wie Chromstahl Fe + Cr
- Nichtmetall - Nichtmetall = Elektronenpaarbindung
- Bsp.: Kohlendioxid CO2
- Metall und ein Nichtmetall = Ionenbindung
- Bsp.: Eisenoxid Fe203
Halbmetalle

Die kleine Gruppe der Halbmetalle hat Eigenschaften der Metalle, wie auch der Nichtmetalle. So hat beispielsweise Silicium den metallischen Glanz, leitet jedoch die Elektroziät bei Normaltemperatur nicht gut.
Zu der Gruppe der Halbmetalle gehören folgende Elemente:
| B | Bor | typisches Halbmetall |
| Si | Silicium | typisches Halbmetall |
| Ge | Germanium | ist eher ein Metall |
| As | Arsen | typisches Halbmetall |
| Se | Selen | ist eher ein Nichtmetall |
| Sb | Antimon | ist eher ein Metall |
| Te | Tellur | typisches Halbmetall |
| Po | Polonium | ist eher ein Metall |
| At | Astat | ist eher ein Nichtmetall |
Viele der Halbmetalle sind Halbleiter. Das heisst, das sie bei zunehmener Temperatur die Leitfähigkeit des elekt. Stroms zunimmt.
Quellen
- Chemieunterlagen