Die Oktettregel und ihre Ausnahmen
Inhaltsverzeichnis
Die Oktettregel und ihre Ausnahmen
Einführung
Als Oktettregel versteht man in der Chemie ein Gesetz, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist eben unter anderem auf die sogenannte Oktettregel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Atome ihre Valenzelektronen (siehe: [1]). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben kann und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht, so ist dieses Teilchen in einem stabilen Zustand (daher auch der Name Oktett = 8). Diese Regel kann man auf fast alle Bindungen zurückführen. Hier einige Beispiele mithilfe der Lewisformel:¨
Ausnahmen
Doch leider gibt es keine Regeln ohne Ausnahmen. Auch die Oktettregel ist nicht überall anwendbar. Foglich sind die grössten und wichtigsten Ausnahmen aufgelistet.
Halbmetalle
Elemente wie beispielsweise Bor, Silizium, Germanium, etc. sind sogenannte Halbmetalle (im Periodensystem bezeichnet). Halbmetalle haben die Eigenschaft, etrem schwache Anziehungskräfte zu haben. Folglich ist es nicht möglich, dass diese Elemente ganze 8 Valenzelektronen in ihrem Orbit behalten können. Andere Verbindungen mit diesen Elementen sind ausserdem äusserst instabil.
Radikale
Radikale sind Atome, welche mindestens eine einfach besetzte Elektronenwolke besitzen.
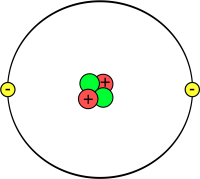
Wasserstoff, Helium
Bei diesen zwei Elementen trifft die Oktettregel nicht zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist.