Abschätzen der Reaktionsenthalpie
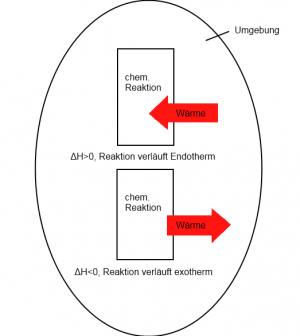
Bei jeder Reaktion wird Energie umgesetzt. Als Reaktionsenthalpie ∆H (Delta H) wird die Wärmeenergie bezeichnet, die bei einer Reaktion freigesetzt (exotherme Reaktion) oder aufgenommen (endotherme Reaktion) wird.
Reaktionen verlaufen dann exotherm wenn aus energiereichen Edukten mit schwachen Bindungen, energiearme Produkte mit starken Bindungen entstehen. Bei der endothermen Reaktion ist dies genau umgekehrt, das enstandene Produkt ist energiereicher als die Edukte.
Das heisst im Allgemeinen, wenn ∆H >0 ist, handelt es sich um eine endotherme Reaktion, bei ∆H <0 um eine exotherme.
Inhaltsverzeichnis
Das Abschätzen:
Um die Reaktionsenthalpie abzuschätzen, muss man den Zusammenhang zwischen der Bindungsstärke und dem Energiegehalt des Teilchens berücksichtigen.
Energiereiche Stoffe enthalten schwache Bindungen.
Energiearme Stoffe hingegen besitzen starke Bindungen.
Grundlagen um abzuschätzen:
Die Bindungstypen
Elektronenpaarbindungen
Zwischen Nichtmetallen besteht die Elektronenpaarbindung. Diese Stoffe werden auch Moleküle genannt. Sie besitzen schwache und starke Bindungen, können daher energiereich oder –arm sein.
Um diese nun unterscheiden zu können. Muss man die Polarität und die Art der Bindung untersuchen.
Die Polarität wird anhand der Elektronegativität ermittelt.
Mehrfach- und polare Bindung führen zu starken Bindungen, dass heisst der Stoff ist energiearm.
→ Beispiel für polare Bindungen: H2O, CO2
→ Beispiel für eine Mehrfachbindung: N2
Einfach- und unpolare Bindungen führen zu energiereichen Stoffen.
→ Beispiel: H2 besitzt eine Einfachbindung
Ionenbindungen
Salze bestehen aus Ionenbindungen, also Bindungen zwischen Metallen und Nichtmetallen. Die Stoffe sind sehr energiearm, da die Bindungskräfte zwischen den Teilchen sehr gross sind.
Um wiederum die Bindungskraft abschätzen zu können muss man die Ladung und Grösse der Atome berücksichtigen.
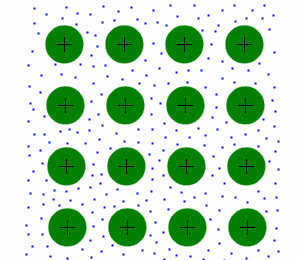
Metallbindungen
Bindungen zwischen Metallen sind sehr energiereich, da sie die schwächsten Bindungen zwischen den Teilchen haben. Es gilt einzig zu beachten ob man es mit einem Metal oder einem Edelmetal zu tun hat. Da nur erstere sehr energiereich sind.
Anwendung
Sofern man weiss, welche Bindungen vorliegen, kann man den Energiergehalt der einzelnen Stoffe abschätzen und daraus die Reaktionsenthalpie berechnen. Aus ∆H kann man nun ableiten ob es sich um eine exotherme oder endotherme Reaktion handelt.
Verwendung
Die Reaktionsenthalpie wird zusammen mit der die Entropie ∆S benötigt, wenn man die freie Enthalpie ∆G einer Reaktion herausfinden will. Wobei die Entropie für die Wahrscheinlichkeit einer Reaktion steht. Ist sie gross ist die Wahrscheinlichkeit dass ein Stoff entsteht gross, ist sie klein ist die Wahrscheinlichkeit gering. Auch nicht zu vergessen ist die Temperatur, diese trägt zur Spontanität massgebend bei!
Messen der Reaktionsenthalpie:
Um die Reaktionsenthalpie zu messen, verwendet man sogenannte Kalorimeter. Dies ist ein nach aussen isoliertes Gefäss, welches die gesamte Wärme aufnimmt. Nun wird die Temperatur vor und nach der Reaktion gemessen und daraus die Reaktionsenthalpie abgeleitet.
Quellen
- Chemieunterlagen
- wikipedia
- Elemente, öbvhpt VerlagsgmbH & Co. KG, Wien 2006, ISBN-10: 3-209-04924-6