Anwendungen: "Kalkerosion und Kalkkreislauf"
Inhaltsverzeichnis
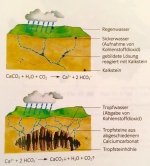
Der Kalkkreislauf in der Natur
Wenn der Untergrund in der Natur aus Kalk besteht, hat es häufig Spalten und Höhlen im Gestein, welche durch die Umwandlung des Calciumcarbonates (Kalk) in das leichtere Calciumhydrogencarbonat entstehen. Diese Reaktion findet statt, wenn CO2-haltiges Regenwasser in das Gestein eindringt. Das Regenwasser nimmt auf dem Weg durch die Luft Kohlenstoffdioxid auf und beim Eindringen in den Boden entstehen die Furchen, da Calciumhydrogencarbonat durch das geringere Gewicht weniger Platz einnimmt.
Die Reaktionsgleichung dieser Gleichgewichtsreaktion sieht folgendermassen aus:
Ca(HCO3)2(aq) ⇌ CaCO2(s) + H2O(l) + CO2(g)
Tropfsteinhöhlen
Genau durch diesen Vorgang entstehen Tropfsteinhöhlen. Wenn ein Wassertropfen die Decke einer Höhle erreicht, entweicht das CO2) in die Höhle, da diese einen Mangel an CO2 hat und eine Verschiebung des Gleichgewichts innerhalb der obigen Gleichung führt dazu, dass es eine Kalkablagerung an der Decke der Höhle entsteht. Solche Ablagerungen entwickeln sich zu den sogenannten Stalaktiten. Derselbe Vorgang kann sich am Höhlenboden abspielen, wenn ein Wassertropfen zu Boden fällt, bevor das CO2 entweicht, die vom Boden herausragenden Kalkgebilde werden Stalagmiten genannt. Die Ablagerungen wachsen jährlich um circa 0,2 mm.
Wie findet man heraus, wo das Gleichgewicht in der Gleichung liegt?
Das Gleichgewicht ist immer bestimmbar, wenn der CO2-Gehalt bekannt ist. Dieser ist abhängig von der Wasserhärte. Beispielsweise Pflanzen haben einen tiefen Kohlenstoffdioxidgehalt durch die Photosynthese, weshalb das Gleichgewicht links liegt. Seen haben folglich weiches Wasser, da durch die Algenpflanzen das Gleichgewicht links gehalten wird.
Allgemein kann gesagt werden:
CO2-Wert tief - Gleichgewicht links - weiches Wasser (geringer Kalkgehalt) - Kalkablagerungen
CO2-Wert hoch - Gleichgewicht rechts - hartes Wasser (hoher Kalkgehalt) - keine Kalkablagerungen
Wasserhärte
Die Wasserhärte hängt von der Ca2+, Mg2+, Sr2+ und Ba2+ Konzentration ab. Der Begriff "Wasserhärte", bzw. "hartes Wasser" ist entstanden, weil beim Waschen mit hartem Wasser die Wäsche hart wird und umgekehrt mit weichem Wasser sehr fein und angenehm wird. Die benutzte Seife bildet nämlich Kalkseife gemeinsam mit dem harten Wasser.
Es gibt neuerdings nur noch die drei Abstufungen "hart", "mittel" und "weich" und keine Zahlenskala zur Angabe der Wasserhärte.
Kalkbrennerei
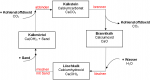
Das Brennen von Kalk wird als technischer Kalkkreislauf oder Kalkbrennerei bezeichnet. Der Kalkstein wird oft als Baustoff und zur Herstellung von Zement, Brannt- und Löschkalk benutzt.
Branntkalk: Durch die Erhitzung des Kalkes auf circa 1000 Grad Celsius zerfällt er in CO2 und Calciumoxid.
Löschkalk: Calciumoxid und Wasser reagieren exotherm, weshalb die Reaktion der beiden als Löschen des Calciumoxides bezeichnet wird.
Kalkmörtel: Löschkalk vermischt mit Sand und Wasser wiederum ergibt Mörtel, welcher früher als Bindemittel von Mauersteinen verwendet wurde, mittlerweile jedoch von Zement ersetzt worden ist. Wenn Kalkmörtel Kohlenstoffdioxid aus der Luft aufnimmt, entsteht wieder Calciumcarbonat.
Die obig erklärten Vorgänge können also in einem Kreislauf zusammengefasst werden, der technische Kalkkreislauf.
Quellen
- Chemieunterlagen von Herr R. Deuber
- Wikipedia: Technischer Kalkkreislauf
- Elemente: Grundlagen der Chemie für Schweizer Maturitätsschulen, Klett und Balmer Verlag Zug, 1. Auflage, 2007
- Elemente: Chemie 1, Unterrichtswerk für Gymnasien, Ernst Klett Verlag Deutschland, 1. Auflage, 1986
- Elemente: Sicher und kompetent zur Matura, ÖBV Verlag, 1. Auflage, 2011