Die Beeinflussung der Reaktionsgeschwindigkeit
Unter Reaktionsgeschwindigkeit (RG) versteht man die sich ändernde Konzentration (Δc) pro Zeiteinheit (Δt).
• RG = Δc / Δt.
Die Reaktionsgeschwindigkeit gibt also an, wie schnell Edukte zu Produkte reagieren. Oder anderst gesagt, sie die Reaktionsgeschwindigkeit gibt an, wie viele Teilchen pro Zeit in einer chemischen Reaktion umgesetzt werden. Die Reaktionsgeschwindigkeit hängt von mehreren Faktoren ab. Diese Faktoren sind Zerteilgrad, Konzentration, Temperatur, Druck und Katalysator. Reaktionen enstehen oft nur dann, wenn Teilchen erfolgreich zusammenstossen. Für einen erfolgreichen Zusammenstoss müssen nun zwei Bedingungen erfüllt sein:
• Der Zusammenstoss muss stark genug sein, um eine Reaktion auszulösen
• Der Zusammenstass muss in einer
Je mehr Zusammenstösse es gibt, desto grösser ist die Reaktionsgeschwindigkeit. Bei Zunahme jedes, obengennanten Faktors, werden diese Zusammenstösse der Teilchen erhöht und somit führt dies zu einem schnelleren Verlauf der Reaktion.
Inhaltsverzeichnis
Zerteilungsgrad
Teilchen können nur an den Grenzflächen kollidieren und miteinander reagieren. Je grösser nun diese Grenzfläche sind, desto mehr Zusammenstösse sind möglich. Je grösser also der Zerteilungsgrad oder die Oberfläche der Teilchen ist, desto höher ist die Reaktionsgeschwindigkeit. Es gibt unterschiedliche Möglichkeiten zur Oberflächenvergrösserung von Feststoffen: - Zerkleinerung - Schmelzen, Verdampfen - Auflösen in einem Lösungsmittel
Beispiele: Biologie/Feuerspeien/Düsenflugzeug
Unser Körper profitiert von der Reaktionsgeschwindigkeitserhöhung durch die Oberflächenvergrösserung. So finden wir in der Lunge 300 Millionen Lungenblässchen mit einer Gesamtgrösse von 100m2), was den Gasaustausch von Sauerstoff und Kohlendioxid ermöglicht. Die Resorption der Nährstoffe vom Darm ins Blut wird erst durch die Darmoberfläche von 180m2), welche von den Darmzotten ensteht, ermöglicht.
Das Prinzip der Oberflächenvergrösserung ist auch die Grundlage beim Feuerspeien. Das Brandmittel (z.B. Alkohol), welches im Anfangszustand schwerer entzündlich ist, wird beim Herauspusten fein zerstäubt, wodurch Angriffsoberfläche für das Feuer vergrössert und dadurch leichter entzündbar wird.
Konzentration
Je höher die Konzentration ist, desto mehr Teilchen sind in einem bestimmten Volumen vorhanden. Dies führt zu einer höheren Zusammenstosswahrscheinlichkeit der Reaktionspartnern.
Experimentelle Bestimmung von k
Temperatur
Je höher die Temperatur ist, desto höher ist der kinetische Energie (Bewegungsenergie) der Teilchen. Dies führt wiederum zu mehr Zusammenstössen und somit zu einem schnelleren Reaktionsverlauf. Vorraussetzung damit eine Reaktion abläuft ist, dass ein bestimmter Energiebetrag erreicht oder überschritten werden muss. Es muss also eine Aktivierungsenergie (AE) hinzugefügt werden, damit diese Schwelle überschritten erreicht oder überschritten werden kann. Diese zusätzliche Energie ist notwendig damit vorhandene Bindungen gelöst werden können.
RGT-Regel
Die Reaktionsgeschwindigkeits-Temperatur-Regel (RGT-Regel), sagt aus, dass eine Erhöhung der Temperatur um 10°C eine Verdoppellung der Reaktionsgeschwindigkeit bewirkt. Wohingegen eine Verdoppellung der Konzentration eines Edukts auch zu einer Verdoppellung der Reaktionsgeschwindigkeit führt.
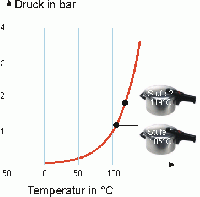
Dampfkochtopf
Eine gute Veranschaulichung der RGT-Regel sieht man am Prinzip des Dampfkochtopfs. Durch die Erhöhung der Wassertemperatur auf 100°C beginnt das Wasser vom flüssigen in den gasförmigen Zustand zu verdampfen. Da das Wasser, bei gleicher Anzahl Teilchen, im gasförmigen Zustand ein grösseres Volumen einnimmt als im flüssigen Zustand und es nicht durch den Dampfkochtopf entweichen kann, erhöht sich der Druck. Bei höherem Druck steigt des Siedepunkt von Wasser. Im Falle des Dampfkochtopfs auf 120°C. Die Temperaturdifferenz von 20°C, die sich dadurch ergibt, führt zu einer Vervierfachung der Reaktionsgeschwindigkeit. Das heisst die Kochzeit mit Benützung eines Dampfkochtopfs wird viermal schneller. Den genaue Gegenteil erlebt man beim Bergsteigen. Je höher über Meer man sich befindet, desto tiefer ist der Druck. Dies führt dazu, dass der Siedepunkt von Wasser tiefer wird.
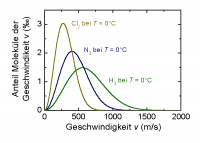
Boltzmann-Verteilung
Damit eine Reaktion ensteht muss die Aktivierungsenergie erreicht oder überwindet werden. Die Boltzmann-Verteilung ist eine Wahrscheinlichkeitsverteilung
Die mittlere kinetische Energie ist proportional zur Temperatur. Die Reaktionsgeschwindigkeit ist proportional zum Anteil Teilchen, welche mindestens die Aktivierungsenergie aufweisen. Sie ist aber nicht proportional zur mittleren kinetischen Energie. -> Die RG ist wesentlich stärker abhängig von der Temperatur als der Temperaturunterschied.
x
Wieso trocknet nasse Wäsche an der Luft?
Bei 100°C verdampft Wasser. Die Wasserteilchen gehen in den gasförmigen Zustand über. Dies geschieht ebenfalls bei der nassen Wäsche, nur dass die Wasserteilchen nicht verdampfen sondern verdunsten. Laut Boltzmann-Verteilung gibt es auch bei tiefer Temperatur immer noch eine Wahrscheinlichkeit, auch wenn sie noch so klein ist, dass einzelne Teilchen die Schwelle der Aktivierungsenergie erreichen. Sie können sich also von den übrigen Wasserteilchen der Wäsche loslösen. Sie verdampfen.
Druck
Bei Erhöhung des Druckes, wird das Volumen des gasförmigen Reaktionspartner verringert, was zu einer Konzentrationserhöhung der Teilchen und zu einer höheren Zusammenstosswahrscheinlichkeit führt. Man kann den Druck durch zwei Arten erhöhen. Entweder man drückt in einen bestimmten Raum zusätzliche Gasteilchen hinein oder man verkleiner den Raum, in dem sich die besthenden Gasmoleküle befinden. Die Druckerhöhung beschleunigt nur Reaktion, bei denen mindestens ein gasförmiger Reaktionspartner beteiligt ist.
Katalysator
Ein Katalysator ist ein Reaktionsbeschleuniger. Er geht eine Bindung mit einem Reaktionspartner ein und senkt dadurch die Aktivierungsenergie, was die Reaktionsgeschwindigkeit immens erhöht, und löst sich danach wieder. Der Katalysator geht also nicht in die Reaktionsgleichung ein und er wird nie verbraucht. Heterogene Katalysator: Auto Homogene Katalysator: Enzyme (auch Biokatalysatoren). Das Funktionieren unseres Körpers beruht auf extrem schnellen Reaktionsabläufen, welche durch Enzyme erreicht wird.
Genauere Informationen siehe: [[1]]
Quellen
- Chemieunterlagen
- http://www.leifiphysik.de/web_ph09/umwelt_technik/07dampfdruck/dampftopf.gif
- http://de.wikipedia.org/wiki/Landolt-Reaktion
- http://de.wikipedia.org/wiki/Maxwell-Boltzmann-Verteilung
- Chemie macchiato: Cartoonkurs für Schüler und Studenten, Autor: Kurt Haim / Johanna Lederer-Gamberger / Klaus Müller
- http://de.wikipedia.org/wiki/Kinetik_%28Chemie%29
- http://de.wikibooks.org/wiki/Datei:Reaktionsgeschwindigkeit-Temperatur.png
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
Source-Code:
Der Source Code sieht dan wiefolgt aus: Dies ist das Template mit dem Sie alle arbeiten können:
Ein Text vor dem ersten Titel wird oberhalb des Inhaltsverzichnisses angezeigt == Erster Titel == Hier gibt's ein Bild: [[image:Molmod_ak.gif|thumb|right|Bild eines Antikörpers; für eine detailliertere Sicht siehe [http://swisseduc.ch/chemie/molmod/anwendungen/antikoerper/]]] === Erster Untertitel === So wird ein Link inerhalb des Wikis gemacht: Hier gehts zu den [[I Grundlagen]] ==== Erster Unteruntertitel ==== So wird eine chemische Formel geschrieben: (H<sub>2</sub>SO<sub>4</sub><sup>2-</sup>). == Zweiter Titel == Pfeil: → Gleichgewichtspfeil: ⇌ == Quellen == * Chemieunterlagen == Weblinks == * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden