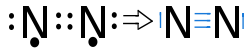Einfache Moleküle
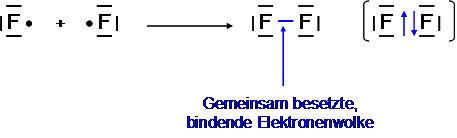
Als einfache Moleküle verstehen wir eine durch Elektronenpaarbindung (A Elektronepaarbindung) entstande Bindung zwischen zwei gleichen Nichtmetallen (siehe Wichtige Nichtmetall-Elemente). Durch die Bildung gemeinsamer Elektronenpaare (eines oder mehrere) wird die gegenseitige Abstossung der positiv geladenen Atomkerne verhindert. Das gemeinsame Elektronenpaar gehört beiden Bindungspartnern und verteilt sich symmetrisch auf einer gedachten Achse zwischen den Atomkernen. Dadurch erfüllen die an der Bindung beteiligten Atome die Oktettregel, erreichen also den Zustand eines Edelgases. Energetisch erreichen beide Bindungspartner einen niedrigeren Energiezustand als jeder Partner alleine mit einem ungepaarten Elektron.
Inhaltsverzeichnis
Voraussetzungen
- verschiedene Spins
- Anziehungskräfte durch Coulombkräfte
- gemeinsame, bindende Elektronenwolke
→ folgende Bindungen kommen dafür in Frage:
Beispiele
Das Wasserstoffmolekül H2
Kräfte zwischen den H-Atomen
1) Magnetische Kräfte (Spin) ↑↓:
Anziehung ↑↓ Abstossung ↑↑ ↓↓
2) Anziehende Coulombkräfte:
Kern1 - Hülle2
Kern2 - Hülle1
3) Abstossende Coulombkräfte:
Hülle1 - Hülle2 Kern1 - Kern2
Epot bei Wasserstoffmolekülbildung
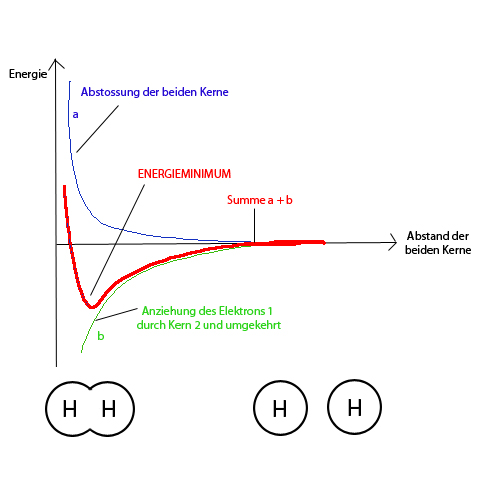 Zu Beginn überwiegen die Anziehungskräfte, die Teilchen nähern sich an, die potentielle Energie sinkt (es wird Energie frei). Beim unteren Ende der KRuve überwiegen dann die Abstossungskräfte, insbesondere die der Kerne. Von nun an müsste man Energie aufwenden für eine weitere Annäherung. Deshalb pendelt sich der Abstand zwischen den beiden Atomen bei eben diesem Tiefpunkt von Epot ein (bei 74 picometer Abstand).
Zu Beginn überwiegen die Anziehungskräfte, die Teilchen nähern sich an, die potentielle Energie sinkt (es wird Energie frei). Beim unteren Ende der KRuve überwiegen dann die Abstossungskräfte, insbesondere die der Kerne. Von nun an müsste man Energie aufwenden für eine weitere Annäherung. Deshalb pendelt sich der Abstand zwischen den beiden Atomen bei eben diesem Tiefpunkt von Epot ein (bei 74 picometer Abstand).
Das Fluormolekül F2
→ Sp3-Hybridisierung (kein P-Orbital)
Das Sauerstoffmolkül O2
Zum Erreichen der Edelgaskonfiguration fehlen dem Sauerstoffatom 2e-
→ Jedes Sauerstoffatom stellt 2 Bindungselektronen zur Verfügung
→ Zweifachbindung / Doppelbindung
Das Stickstoffmolekül N2
Es fehlen zum Erreichen der Edelgaskonfiguration 3 e-
→ Jedes Stickstoffatom stellt 3 Bindungselektronen zur Verfügung
→ es liegt eine 3fach Bindung zwischen den Atomen vor, von denen jedes je ein freies Elektronenpaar hat
Quellen
- Chemie-Unterricht Notizen
- Graphics made by Urs Wegmann
- Chemsketch (animierte GIFs)
- Buch: "Elemente"; Roderich Magyar, Wolfgang Lieebhart, Gabriela Jelinek; öbvhpt Verlagsgmbh & Co. KG; Wien 2006