Historisches
Bis zum Ende des 19. Jahrhunderts kannte man die Atomstruktur (Hüllen/Schalen) noch nicht. Man konnte auch noch nicht zwischen Elementen und Verbindungen unterscheiden. Es bestand aber ein grosses Wissen über die Reaktionen von verschiedenen Stoffen und deren Eigenschaften. Chemie ist jedoch immer eine Wechselwirkung zwischen Struktur der Atome und den daraus folgenden Eigenschaften und Reaktionsverhalten. Es fehlte zu der Zeit also noch ein grosses Stück der Chemie.
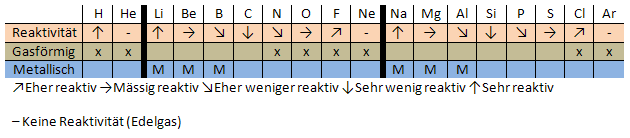
Ende 19. Jh. lernte man Elemente von Verbindungen zu unterscheiden und die Masse der Atome zu bestimmen. Naheliegend, die entdeckten Elemente nach Atommasse zu ordnen. Damit begannen Lothar Meyer und Dimitri Medelejew zeitgleich und unabhängig im Jahre 1860. Das Periodensystem ähnelte noch einem Bandwurm der Elemente Ordnet man die Elemente nach steigender Atommasse an, und betrachtet deren Eigenschaften, ergeben sich Besonderheiten, wie an folgender Darstellung ersichtlich wird:
Meyer und Medelejew entdeckten die Brüche im Periodensystem (auf nicht reaktives, gasförmiges Element, z.B. Neon, folgt sehr reaktives, festes Element, in diesem Beispiel Natrium). Man begann den Bandwurm an diesen Stellen zu brechen, da man sah, dass sich die Eigenschaften der Elemente periodisch wiederholen. So entstanden Perioden und Gruppen. Es gab immer noch einige Lücken im Periodensystem, die Eigenschaften dieser Elemente konnte Mendelejew jedoch aufgrund der Regelmässigkeit des Systems sehr genau vorhersagen. Er sagte drei Elemente voraus, die einst entdeckt würden. Ekabor, Ekaaluminium und Ekasilizium, benannt nach den Elementen, die ihnen am nächsten stehen. Diese drei Elemente wurden später tatsächlich entdeckt – Gallium (Ekaaluminium), Scandium (Ekabor) und Germanium (Ekasilizium). Da Mendelejew auch nach der Entdeckung dieser fehlenden Elemente recht behielt, kann man sagen, dass das Periodensystem ein sehr potentes Arbeitsmittel in der Chemie ist.
 Aufbau des Periodensystems in Perioden und Gruppen
Aufbau des Periodensystems in Perioden und Gruppen
Als die Neutronen entdeckt wurden hat Henry Moseley erkannt, dass man nicht nach Atommasse, sondern nach einer experimentell bestimmbaren Ordnungszahl, die der Zahl der Protonen entspricht, ordnen muss. Dies ist so, weil die Neutronen die Masse eines Atoms beeinflussen, jedoch nicht die Eigenschaften. Das Periodensystem soll aber nach den Eigenschaften und nicht nach der Masse ordnen.