Löslichkeit
Bei der Löslichkeit eines Stoffes handelt es sich um eine Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Reinstoff in einem Lösungsmittel löst. Bei dem Lösungsmittel handelt es sich meist um eine Flüssigkeit in der sich der Reinstoff unter homogenen (gleichen) Bedingungen lösen kann. Das Lösungsmittel muss aber nicht unbedingt eine Flüssigkeit sein, es kann sich beim Lösungsmittel auch um feste Stoffe handeln.
Inhaltsverzeichnis
Löslichkeit
Die qualitative Löslichkeit beschreibt, ob ein gewisser Feststoff mit einer Flüssigkeit gut löslich ist.
Genauer gesagt bestimmen die molekularen Eigenschaften des Stoffes sowie die Eigenschaften der Flüssigkeit ob sich
ein Reinstoff in einer gewissen Flüssigkeit löst oder nicht.
Wir kommen zu der Frage: Was löst was? - Die mittelalterlichen Alchemisten stellten dafür den Merksatz
"similia similibus solvuntur" auf. Zu Deutsch: Ähnliches wird durch Ähnlichem gelöst. Da sie bemerkten,
dass polare Stoffe (Die polare Bindung) in polaren Lösungsmitteln gut, in unpolaren Lösungsmittel
aber schlecht löslich sind. Bei unpolaren Stoffen wiederum gilt, dass sie in unpolaren Lösungsmitteln (z.B.
Pentan) gut, in polaren aber schlecht löslich sind.
Wir unterscheiden somit zwischen hydrophilen (polaren) und lipophilen (unpolaren) Stoffen:
- hydrophile Stoffe (z.B.: Salze --> Ionengitter(Bildung des Ionengitters)) lösen in wasserartigen
Flüssigkeiten, sprich in polaren Lösungsmitteln.
- lipophile Stoffe (z.B.: wachsartige und fettige Stoffe) lösen in Flüssigkeiten wie Benzin, sprich in
unpolaren Lösungsmitteln bzw. organischen Lösungsmitteln.
Man unterscheidet zwar zwischen diesen beiden Punkten, jedoch muss man auch erwähnen, dass es sehr
viele Stoffe gibt, die sich sowohl in einem polaren sowie auch in einem unpolaren Lösungsmittel lösen.
Anwendungen der Löslichkeit
Es gibt viele Anwendungen der Löslichkeit, doch speziell und uns am meisten verbunden ist wahrscheinlich die Anwendung in der Nahrungsmittelindustrie und Waschmittelherstellung. Deshalb auch die folgenden Beispiele:
Alkohol im Wein
Beim Gären wird grundsätzlich Zucker zu Alkohol umgewandelt. Alkohol ist ein wenig lipophil (aber auch hydrophil) und löst daher lipophile Farbstoffe.
Betanin: Pflanzlicher Farbstoff (Lebensmittel)
Mit diesem Wissen, kann man sich auch die folgende Frage beantworten.
Weshalb ist der Dôle blanche weiss, obwohl er aus blauen Trauben hergestellt wird?
Der Trick liegt darin, dass die Schale vor dem Gären abgetrennt wird und somit gibt es für den Alkohol nichts mehr zu heraus lösen.
Würde man hingegen die Schalen der Trauben erst nach dem Gären entfernen, hätte der Alkohol die Möglichkeit, den Farbstoff aus den Schalen zu lösen. Dies hätte dann zur Folge, dass es sich um einen Dôle rouge handeln würde und nicht um einen Dôle blanche.
Es wird zuerst die Schale abgetrennt, und dann gibt es für den Alkohol nichts mehr raus zu lösen.
Hingegen wenn die Schale nach dem Gären entfernt wird kann der Alkohol den Farbstoff aus der Schale herauslösen und so wäre der Wein dann rot.
Waschmittel
In der Zeit als es noch üblich war etwas für die Götter zu opfern entstand die Seife. Durch das Braten der Tiere über dem offenen Feuer tropfte das Fett in die Asche und das Produkt der beiden Stoffe war Seife.
Bei dem Seifenmolekül handelt es sich um ein Molekül mit einem hydrophilen und einem lipophilen Ende. Aus diesem Grund werden solche Moleküle von Schülern oft als "Zwittermoleküle" bezeichnet. Durch ihre Gegebenheit haben sie die Funktion als Lösungsvermittler übernommen. Lösungsvermittler sind Stoffe, die die lipophile in hydrophilen Lösungsmitteln und hydrophile in lipophilen Lösungsmittel lösen.
Reinigt man also einen Fettfleck auf den Textilien mit Seife, bindet sich das lipophile Ende an den (Fett-)Fleck und umschliesst ihn. Beim Spülen mit Wasser bindet sich das andere, hydrophile, Ende an die H₂O Teilchen und wird weggeschwemmt.
Emulgatoren/Detergentien
Was sind Emulgatoren/Detergentien... Während man in der Nahrungsmittelindustrie von Emulgatoren spricht, nennt man diese Hilfsstoffe in der Waschmittelherstellung Detergentien.
Experimente
Was löst Wasser und was löst Pentan?
In der untenstehenden Tabelle, sowie den Bildern, sieht man wie sich gewisse Stoffe in Wasser und andere Stoffe in Pentan lösen. (Wasser und Pentan können sich nicht mischen). Die Stoffe, die sich in Wasser lösen sind hydrophile (wasserlöslich) Stoffe, die die sich in Pentan lösen sind lipophile (fettlöslich) Stoffe.
Erklärung: Betrachtet die Strukturen der Stoffe, lösen sich die Stoffe, die eine oder mehrere Wasserstoffbrücken besitzen, in Wasser (hydrophil), wenn keine Wasserstoffbrücken vorhanden sind, lösen die Stoffe sich in Pentan (lipophil). Es gibt auch viele Stoffe, die sich in polaren sowie in unpolaren Lösungsmittel lösen.
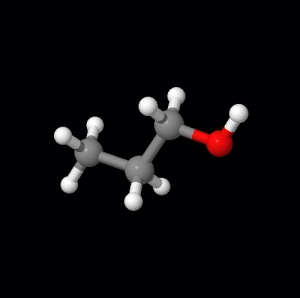
Beispiel hierfür Propanol.
Strukturbetrachtung (ZMK)
Betrachtet man die Struktur der hydrophilen, lipophilen und deren Stoffe die beides sind, so ist ein
unterschied erkennbar. Wie bereits angesprochen spielen die „OH“-Gruppen eine entscheidende Rolle.
Wiederum nützlich für die Erkennung eines hydrophilen oder lipophilen Stoffes sind die
Zwischenmolekulare Kräfte. (ZMK)
• Sind die Anziehungskräfte innerhalb des Moleküls stark, so handelt es sich um eine hydrophile
Struktur.
• Sind die Anziehungskräfte innerhalb des Moleküls schwach, so handelt es sich um eine lipophile
Struktur.
• Sind die Anziehungskräfte innerhalb des Moleküls „mittel“, so ist der Stoff in einer hydrophilen
sowie in einer lipophilen Lösung löslich.
hydrophil, lipophil oder gar beides?
• Ein Stoff ist hydrophil, wenn es an den Enden des Moleküls nur
„OH“-Atome gibt.
• Ein Stoff ist lipophil, wenn der Stoff an keinem Ende „OH“-besetzt
ist.
• Ein Stoff ist hydrophil sowohl auch lipophil, wenn er am einen Ende
eine „OH“-Besetzung hat und am anderen Ende keine „OH“-Besetzung
hat. (Lösungsvermittler-Prinzip)
Quellen
• Chemieunterlagen des 1. und 2. Jahres an der Kantonsschule Baden • Bilder wurden von den Autoren selbst erstellt und bearbeitet mit Aussnahme von "Propanolstruktur" und "Seifenmolekül"
Weblinks
- Löslichkeit Wikipedia (http://de.wikipedia.org/wiki/Löslichkeit/)
- Lenntech (http://www.lenntech.com/deutsch/Element-und-Wasser/Loeslichkeit.htm)
- Hier findet man ein virtuelles Propanol Molekül
(http://www.bioc.uzh.ch/bipweb/lexikon/metaboliten/npropanol/npropanol.html)
- Funktionsweise von Seifen (http://dblay.de/einblicke/wasch/seife)
bearbeitet und verfasst von Mike Bertschinger und Andrea Talarico