Aufbauprinzip der Elektronenhülle
Die Elektronenhülle wird auch Atomhülle genannt. Alle in der Chemie wichtigen Eigenschaften hängen vom Aufbau der Elektronenhülle ab. Denn bei einer chemischen Reaktion gibt es einzig eine Veränderung der äussersten Elektronen, im Atomkern passiert nichts.
Inhaltsverzeichnis
Die Elektronenhülle: Aufbau der Atome
Ein Atom ist das kleinste Teilchen, welches auf chemischem Wege nicht weiter geteilt werden kann. Das Atom besteht aus dem Atomkern und der Elektronenhülle. Im Atomkern befinden sich die positiv geladenen Protonen und die neutralen Neutronen. Der Atomkern macht den Hauptteil des Gewichts eines Atoms aus. Um den Atomkern herum befindet sich die Elektronenhülle. Die Protonen im Atomkern und die Elektronen in der Elektronenhülle ziehen sich an, weil sie gegensätzlich gelanden sind. Um nicht am Atomkern "festzukleben" kreisen die Elektronen mit einer spezifischen Geschwindigkeit um den Atomkern.
Grössenverhältnis von Elektronenhülle zu Atomkern
Das Grössenverhältnis von Elektronenhülle zu Atomkern ist bemerkenswert. Der Durchmesser der Hülle beträgt etwa 10-10 m, der Durchmesser des Kerns etwa 10-15 m bis 10-14 m. Der Kern ist also etwa 23'000-mal kleiner als die Hülle. Zur Veranschaulichung dieses Verhältnisses kann man das Atom in Gedanken auf das 1012fache vergrössern. Die Hülle hätte dann einen Druchmesser von 100 m, Kern wäre aber nur 4 mm gross.
Der Aufbau der Elektronenhülle: Das Bohrsche Modell
Die negativ geladenen Elektronen bilden die Elektronenhülle. Sie umkreisen in bestimmten Schalen den Atomkern. Diese Schalen sind verschiedenen Energiestufen zugeteilt und können jeweils nur eine gewisse Anzahl von Elektronen aufnehmen. Die maximale Anzahl Elektronen für eine Energiestufe ist durch die Formel 2n2 gegeben. N steht dabei für die Nummer der, von innen nach aussen, gezählten Elektronenschalen. Im Periodensystem werden diese Schalen mit K, L, M, N, O usw. -Schale bezeichnet.
Um ein Elektron aus der Atomhülle abzutrennen, benötigt man Energie. Dabei zeigt sich, dass für die einzelnen Elektronen einer Hülle unterschiedlich viel Energie aufgewendet werden muss. Da die Elektronen in unterschiedlichen Schalen platziert sind, halten sie mehr oder weniger am Atomkern fest.
Elektronen mit geringerer Energie und damit festerer Bindung an den Kern sind in kernnahen Schalen zu finden, während die Elektronen mit stärkerer Energie und schwächerer Bindung eher ausserhalb des Atomkerns anzutreffen sind.
Heute hat man allderdings die Vorstellung der Elektronen in den Schalen wieder aufgegeben. Diese Vorstellung missachtet ein wichtiges naturwissenschaftliches Gesetz. Nach diesem Gesetz strahlt ein geladenes Teilchen (Elektron) welches eine ungleichförmige Bewegung macht (Kreisbewegung) Energie in den Raum ab. Daher müsste das Elekron nach kurzer Umlaufzeit auf den Atomkern fallen, weil es keine Energie mehr hat.
Das heisenbergsche Unschärferelationsgesetz wurde des weiteren missachtet. Nach diesem Gesetz ist es prinzipiell unmöglich, den Ort und zugleich auch den Impuls eines Teilchens genau festzulegen. Je genauer der Ort eines Teilchen bestimmt wird, desto ungenauer ist die Bestimmung des Impulses und damit die Energie des Atoms. Nach dem heisenbergschen Unschärferelationsgesetz hat der Ort des Elektrons überhaupt keine Relevanz mehr, denn der Energiewert eines Elektrons ist auf einer Kreisbahn exakt festgelegt.
Der Aufbau der Elekrtonenhülle: Das heutige Modell
Heute hat man erkannt, dass das Elektron in der Hülle nur in bestimmten Energiestufen existieren kann. Bohr hat diese Stufen Schalen genannt, heute nennen wir sie Sphären. Wir haben aber das System, dass mehrere Elektronen in einer Schale / Sphäre sein können beibehalten. Mann nimmt aber keine Kreisbahnen mehr an, auf denen sich die Elekrtonen bewegen, sondern Raumbereiche, in denen das Elektron, wie schon gesagt, nicht genauer definiert werden kann.
Die Spären werden heute von innen nach aussen nummeriert. Die jeweilige Nummer ist dann auch gleich die Hauptquantenzahl (n=1, n=2, ...). Ausserdem werden alle Spähren auch noch mit einem Buchstaben marktiert, gleich wie beim Bohrschen Modell. Auch die Anzahl der Elekrtonen pro Spähre hat sich nicht verändert.Die Formel bleibt sich bis heute gleich: 2n2, wobei n = Hauptquantenzahl.
Kommt es zu einer chemischen Reaktion, nehmen im Allgemeinen nur die Elektronen der äussersten Schale teil. Diese äussersten Elektonen werden Valenzelektronen genannt. Sie können auch rechnerisch bestimmt werden.
Geht man beispielsweise von Germanium mit der Kernladungszahl 32 aus, so besitzt das Atom 32 Protonen und damit auch 32 Elektronen. "Füllt" man diese 32 Elekrtonen in die Sphären des Atoms, so können in der ersten Sphäre 2x12 = 2 Elektronen untergebracht werden. Es bleiben also noch 30 Elektronen für die anderen Sphären. In der zweiten Späre befinden sich 2x22 = 8 Elektronen. Nachem bleiben noch 22 Elektronen übrig. In der dritten Sphäre können 2x32 = 18 Elekronen untergebracht werden und es bleiben somit noch 4 Elektronen für die vierte Sphäre übrig. Germanium besitzt also noch 4 Valenzelektronen.
Die Orbitale
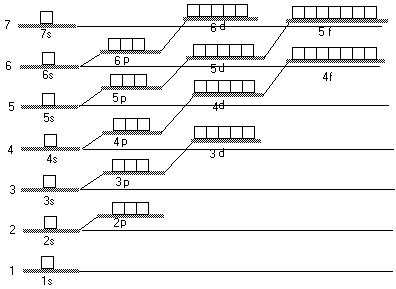
Weitere Untersuchungen haben später ergeben, dass das einfache Sphärenmodell für grössere Atome mit mehreren Elekrtonen nicht ausreicht. Man hat herausgefunden, dass es zu den Quantenzahlen noch genauere Energieniveaus gibt, diese werden Unternieveaus oder auch Orbitale genannt. Sie werden mit den Buchstaben s, p, d, f bezeichnet. Orbitale darf man allerings nicht mit den Kreisbahen des alten bohrschen Atommodells verwechseln, denn es sind genaue Energieangaben für die Elektronen.
Jede Sphäre besteht mindestens aus dem s-Orbital. Das s-Orbital in der ersten Sphäre wird 1s, das s-Orbital in der 2. Sphäre 2s usw. genannt. In der zweiten Sphäre sind auch p-Orbitale möglich. Diese p-Orbitale werden in der zweite Späre 2p, in der dritten 3p usw. genannt. Jeweils drei Orbitale haben in den p-Orbitalen das gleiche Energieniveau. Die d-Orbitale sind dann ab der dritten Sphäre und die f-Orbitale ab der Vierten anzutreffen. Während die d-Orbitalen aus fünf Orbitalen mit gleichem Energieniveau bestehen, hat es in den f-Orbitalen jeweils sieben.
Wird die Hauptquantenzahl n grösser, wird der Ernergieabstand zwischen den Sphären kleiner. Das führt zu "Unregelmässigkeiten". Schon in der dritten Sphäre liegt 4s energetisch tiefer als 3d. Daher wird zuerst die 4s-Orbitale mit Elektronen gefüllt und erst danach die 3d.
Da maximal zwei Elektronen in ein Orbital passen, ergeben sich daraus auch die maximalen Elektronenzahlen pro Sphäre. Sie entsprechen noch immer dem einfachen bohrschen Modell, sind nun aber genau nach Energiestufen aufgeschlüsselt.
Quellen
- Chemieunterlagen
- Elemente; Magyar, Liebhart, Jelinek; öbv&hpt Verlag; 2. Auglage, Nachdruck 2005
- http://www.meduniwien.ac.at/zal/strahlenschutz/physikalischegrundlagen/deraufbauderatomhuelle.html
- http://www.energiewelten.de/elexikon/lexikon/seiten/htm/020202_Atomhuelle_und_Atomkern_Kernphysik.htm
- http://www.pas-berlin.de/chemie/ch-e1/atombau/atombau.html
- http://www.chempage.de/theorie/atome.htm
- http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-12.html
- http://de.wikipedia.org/wiki/Bohr-Sommerfeldsches_Atommodell
- http://www.tgs-chemie.de/nebeng5.gif
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
von David Schmocker