Fällungsreaktionen
Eine Fällungsreaktion ist eine chemische Reaktion, bei der verschiedene, gut lösliche Salze in eine Flüssigkeit gegeben werden. Die Ionen (Müssen nicht alle Ionen der Edukt-Salze sein.) der gelösten Salze (Edukte) bilden jetzt untereinander mindestens ein Salz, dessen Löslichkeit so gering ist, dass sie ein festes Ionengitter bilden und ein Salz im festen Zustand entsteht. Dieses schwerlösliche Salz fällt aus, und es entsteht ein Niederschlag, der durch Trübung erkennbar ist.
Pb(NO3)2 → Pb2+aq + 2NO-aq
KI → K+aq I-aq
Pb2+aq + 2NO-aq + K+aq + I-aq → {PbI2}(s) + 2K+aq + 2NO-aq
Inhaltsverzeichnis
Anwendungen
1. Nachweis von Ionen
Wir haben ein Ion x- und wollen wissen, ob dies in einer Lösung enthalten ist. Dabei nehmen wir an, dass das x- - Ion mit einem y+-Ion ein Salz bildet.
Vorgehen:
1. Ein y+ - Ion suchen, das mit dem Ion x- ein schlecht lösliches Salz bildet. Aber dieses Ion y+ muss in einem gut löslichen Salz enthalten sein.
2. Man gibt das Salz dazu, welches diese Bedingungen erfüllt. Wenn es eine Fällung gibt, respektive eine Trübung, ist das gesuchte Salz x- vorhanden und es entsteht ein Niederschlag.
Beispiel:
Wir wollen wissen, ob in einer Lösung Chlorid-Ionen enthalten sind. Chlorid-Ionen kann man anhand von Silberionen nachweisen. Wenn es eine Fällung gibt hat es folglich Chlorid-Ionen in der Lösung.
2. Kläranlage
In Kläranlagen gibt es einen Reinigungsprozess, in welchen das Wasser in drei verschiedenen Stufen gereinigt wird:
1. Mechanische Reinigung
2. Biologische Reinigung
3. Chemische Reinigung
=== 3.
Die Ladung eines Ions
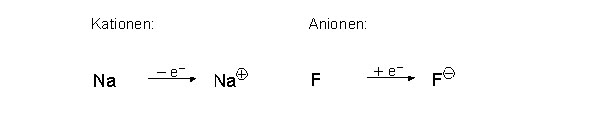
Alle Stoffe haben das Bestreben Edelgaskonfiguration zu erreichen. Bei der Ionenbindung wird dies erzielt indem das Metall Elektronen abgibt und das Nichtmetall diese aufnimmt. Zugrunde dessen liegt, dass Metalle ihre Elektronen nur schwach anziehen und sie somit die Nichtmetalle problemlos rauben können. Die Edelgaskonfiguration wird also entweder durch die Aufnahme oder die Abgabe von Elektronen aus der Valenzschale erzielt. Achtung: Die Elektronenverschiebung hat eine Ladungsverschiebung zur Folge und ändert die Kernladungszahl nicht!
Bei dieser Elektronenverschiebung entstehen positiv und negativ geladenen Teilchen, so genannte Ionen:
Positiv geladenen Ionen --> Kationen
Negativ geladenen Ionen --> Anionen
Kationen und Anionen sind entweder einfach (Na+ bzw. Cl -), zweifach (Mg 2+ bzw. O2-) oder dreifach (Al3+ bzw. N3-) positiv, respektive negativ, geladen. Generell sind Anionen grösser als Kationen, da durch die Elektronenaufnahme die Valenzschale gefüllt wird und somit das Teilchen sich vergrössert. Im Gegensatz dazu, wird das Kation kleiner, da es durch die Elektronenabgabe eine tiefer gelegene volle Valenzschale erreicht. Durch die unterschiedliche Ladung der beiden Ionen ziehen sich Kation und Anion gegenseitig an und schliessen sich zu einer Verbindung zusammen. Diese Zusammenlagerung nennt man Ionenbindung.
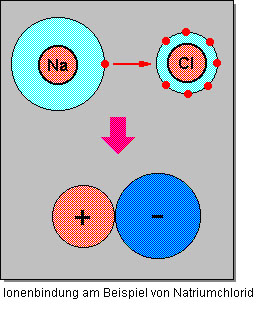
Die Ionenbindung
Bei einer Ionenbindung wirken zwischen den entgegengesetzt geladenen Ionen elektrostatische Anziehungskräfte, so genannte Coulomb’sche Kräfte. Nach dem coulomb’schen Gesetz ist die Anziehungskraft zwischen zwei elektrischen Ladungen
1. von der Größe der Ladungen
2. vom Abstand zwischen den Ladungen abhängig.
Die gegenseitige Anziehung der geladenen Ionen wirkt in alle Richtungen gleich stark. Darum umlagern sich entgegengesetzt geladene Ionen zu einem geordneten Aufbau in einer Verbindung. Es bildet sich ein Ionengitter (ein Kristall), welches eine Gitterstruktur aufweist. Das Ionengitter (Bildung des Ionengitters) ist elektrisch neutral, da sich die entgegengesetzten Ladungen gegenseitig aufheben. Voraussetzung ist die korrekte stöchiometrische Zusammensetzung der kleinsten chemischen Einheit.
Quellen
- Chemieunterlagen