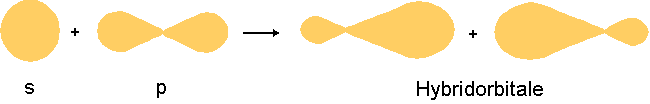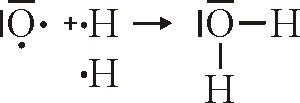Kugelwolkenmodell
Das Kugelwolkenmodell wird zur Vereinfachung der Darstellung des Orbitalmodells verwendet. Es zeigt nur die Valenzschalen der jeweiligen Atome, die Elektronen auf den inneren Schalen werden bei diesem Modell vernachlässigt.
Inhaltsverzeichnis
Das Kugelwolkenmodell
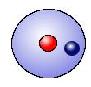
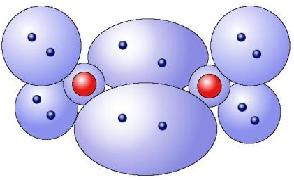
Im Kugelwolkenmodell (KWM) geht man davon aus, dass die Elektronen um ein Atom kugelförmige Aufenthaltsorte haben. Jede dieser Wolken können mit ein oder zwei Elektronen belegt werden. Aufgrund der zunehmenden Grösse der Schalen nehmen auch die Kugelwolken zu, wobei nicht alle der Wolken besetzt werden müssen:
* Erste Schale (K-Schale) = bis zu 2 Elektronen = 1 Elektronenwolke * Zweite Schale (L-Schale) = bis zu 8 Elektronen = 4 Elektronenwolken * Dritte Schale (M-Schale) = bis zu 18 Elektronen = 9 Elektronenwolken * Vierte Schale (N-Schale) = bis zu 32 Elektronen = 16 Elektronenwolken
Jedoch nimmt jede äusserste Schale, wie schon im Bohrschen Modell festgelegt, bis auf weiteres nur acht Elektronen auf!
Es gibt ein paar einfache Regeln, durch die das KWM beschrieben werden kann:
- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle!)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt. Erst ab dem 5. Elektron auf der Schale sind die Elektronen paarweise in den Elektronenwolken verteilt.
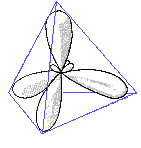
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.
Beispiele zum KWM
Hier folgen ein paar Beispiele, an denen man das KWM gut illustrieren und nachvollziehen kann:
|
Wasserstoff: |
O2: |
Grenzen des Modells
Es gibt Unregelmäßigkeiten in der tatsächlichen Besetzung von Schalen bei den Nebengruppenelementen, die sich nur bei einer Annahme erklären lassen: Es muss noch Unterschalen geben. Das lässt sich aber mit dem Kugelwolkenmodell nicht mehr erklären, da es ja nur die jeweils die äusserste Schale betrachtet.
Vergleich: KWM - Orbitalmodell
| Kugelwolkenmodell | Orbitalmodell | |
| gleich | Schalen der Atome | Schalen der Atome |
| Elektronen haben Wellencharakter | Elektronen haben Wellencharakter | |
| Hund'sche Regel, Pauli-Prinzip | Hund'sche Regel, Pauli-Prinzip | |
| verschieden | sp3-Hybridisierung | s/p-Unterschalen |
| Betonung der Valenzschalen | Berücksichtigung aller Schalen | |
| Bindungen der 1. und 2. Periode können gut beschrieben werden, ab der 3. Periode nur eingeschränkt. Nicht geeignet für Nebengruppen, da diese teilweise gleich viele Valenzelektronen haben wie Atome mit anderer Anzahl an Elektronen |
Hybridisierung
Eine Hybridisierung ist eine Verschmelzung verschiedener Strukturen - es entsteht ein Hybrid. Chemisch gesehen heisst dies, dass verschiedene Orbitale zu Hybridorbitalen verschmelzen.
sp3-Hybridisierung
Die sp3-Hybridisierung bedeutet, es ist ein s-Orbital und drei p-Orbitale an der Hybridisierung beteiligt. Diese vermischen sich und es entsteht folgendes:
Wenn man dies im Raum betrachtet sieht man, dass sich die entstandenen Orbitale möglichst weit voneinander entfernen (109.5°). Sie haben eine tetraedische Form:
Die Lewisschreibweise
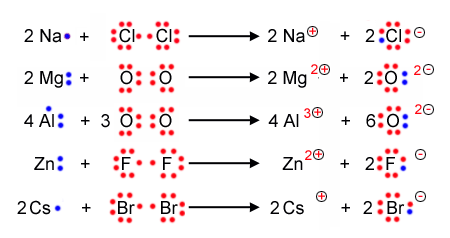
Bei der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wie die Bindungen zwischen Atomen und Molekülen aussehen. Dabei ersetzt man einfach die vollbesetzetn Kugelwolken durch einen Strich und die einfach besetzten Kugelwolken durch einen Punkt.
Beispiele zur Lewisschreibweise
Hier folgen ein paar Beispiele, an denen man die Schreibweie gut illustrieren und nachvollziehen kann:
Bindung von zwei Cl - Atomen
Bindung von H2O
Man kann statt Strichen auch zwei Punkte schreiben:
Quellen
- http://wikipedia.org
- http://google.com
- Heftaufschrieb
- http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/Wichtige%20Begriffe%20mit%20frame.html
- http://www.bionet.schule.de/~grube/fachlehr/chemie/fundamen/valenz.htm
- http://chemie.fb2.fh-frankfurt.de/Erlaeuterungen/11Hybridisierung-sp3.htm