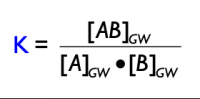Die Beschreibung des Chemischen Gleichgewichts
Achtung: Diese Seite muss überarbeitet werden - Bitte nicht als Lerngrundlage verwenden!
Inhaltsverzeichnis
1. Das Chemische Gleichgewicht
Definition des Chemischen Gleichgewichts
Ein chemisches Gleichgewicht tritt auf, wenn in einem geschlossenen System die Hin- und Rückreaktionen einer chemischen Reaktion mit derselben Geschwindigkeit ablaufen. Dies bedeutet nicht, dass die chemische Aktivität aufgehört hat, sondern dass sich die Konzentrationen der Reaktanten und Produkte nicht mehr ändern.
Bedeutung des Chemischen Gleichgewichts
Das chemische Gleichgewicht ist ein zentrales Konzept in der Chemie, da es die Dynamik vieler chemischer Reaktionen beschreibt, die in der Natur und in der Industrie stattfinden. Es hilft uns zu verstehen, wie Reaktionen unter bestimmten Bedingungen ablaufen und wie wir diese Bedingungen beeinflussen können, um die Ausbeute an gewünschten Produkten zu maximieren.
Wissenschaftlicher Hintergrund
In einem chemischen Gleichgewicht bleiben die Konzentrationen der Reaktanten und Produkte konstant, obwohl die Reaktionen weiterhin stattfinden. Dies wird durch das Massenwirkungsgesetz beschrieben, das die Beziehung zwischen den Konzentrationen der Reaktanten und Produkte in einem Gleichgewichtszustand angibt:
aA + bB ⇌ cC + dD
2. Der Holzapfelkrieg
Um das Konzept des chemischen Gleichgewichts anschaulich zu erklären, verwenden wir das Beispiel des "Holzapfelkriegs". Dieses Beispiel hilft, den Gleichgewichtsprozesses zu visualisieren.
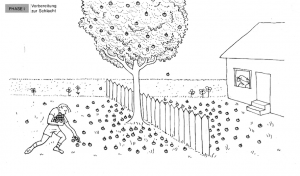
Phase 1: Vorbereitung zur Schlacht
Stellen Sie sich einen Holzapfelbaum vor, der genau auf der Grenze zwischen zwei Gärten steht. In einem Garten wohnt ein Junge, im anderen ein alter Mann. Der Baum trägt viele Holzäpfel, die auf beiden Seiten des Zauns fallen. Zu Beginn sammelt der Junge alle Holzäpfel in seinem Garten auf.
Analogie: Dies entspricht der Sammlung von Reaktanten in einer chemischen Reaktion.
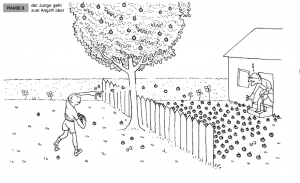
Phase 2: Der Junge geht zum Angriff über
Der Junge möchte die Holzäpfel loswerden und beginnt, sie in den Garten des alten Mannes zu werfen. Der Mann bemerkt dies und beginnt ebenfalls, die Holzäpfel zurückzuwerfen. Die Äpfel werden in beide Richtungen über den Zaun geworfen, wobei zunächst mehr Äpfel im Garten des alten Mannes landen, da der Junge schneller werfen kann.
Analogie: Dies stellt die Hinreaktion dar, bei der die Reaktanten zu Produkten reagieren.
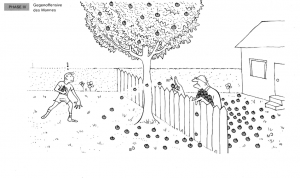
Phase 3: Die Frau beginnt, Äpfel zurückzuwerfen
Die Frau beginnt, die Holzäpfel zurück in den Garten des Jungen zu werfen. Zunächst landen mehr Äpfel im Garten der alten Frau, da der Junge schneller werfen kann.
Analogie: Dies repräsentiert die Rückreaktion, bei der die Produkte wieder zu Reaktanten reagieren.
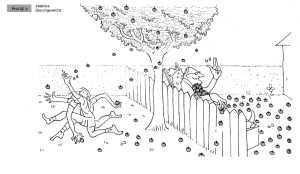
Phase 4: Stabiler Gleichgewichtszustand
Mit der Zeit wirft die Frau genauso viele Äpfel zurück in den Garten des Jungen, wie er in ihren Garten wirft. Es stellt sich ein Gleichgewichtszustand ein, bei dem die Anzahl der Holzäpfel, die in beide Richtungen geworfen werden, gleich ist. Im stabilen Gleichgewichtszustand ändern sich die Mengen an Holzäpfeln in den beiden Gärten nicht mehr, obwohl weiterhin Äpfel hin- und hergeworfen werden.
Analogie: Dies stellt das chemische Gleichgewicht dar, bei dem die Reaktionsgeschwindigkeiten der Hin- und Rückreaktionen gleich sind und die Konzentrationen der Reaktanten und Produkte konstant bleiben.
Wissenschaftlicher Vergleich
In der Chemie entspricht dies einer Situation, in der die Reaktanten A und B zu den Produkten C und D reagieren, bis ein Punkt erreicht ist, an dem die Reaktionsgeschwindigkeiten der Hin- und Rückreaktionen gleich sind:
- A + B ⇌ C + D
Die Konzentrationen der Reaktanten und Produkte bleiben konstant, obwohl die Reaktionen weiterhin stattfinden.
3. das Massenwirkungsgesetzes
Einleitung
Das Massenwirkungsgesetz ist ein fundamentales Prinzip der Chemie, das die Beziehung zwischen den Konzentrationen der Reaktanten und Produkte in einem chemischen Gleichgewicht beschreibt.
Grundprinzipien
Das Massenwirkungsgesetz basiert auf der Beobachtung, dass die Geschwindigkeit einer chemischen Reaktion proportional zu den Konzentrationen der Reaktanten ist. Für eine allgemeine Reaktion der Form:
- aA + bB ⇌ cC + dD
lässt sich das Massenwirkungsgesetz wie folgt formulieren:
- K = [C]c · [D]d ÷ [A]a · [B]b
Hier ist K die Gleichgewichtskonstante, und die eckigen Klammern [] repräsentieren die Konzentrationen der jeweiligen Spezies im Gleichgewichtszustand.
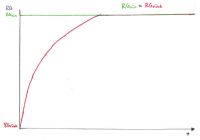
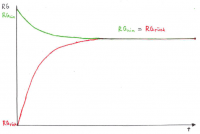
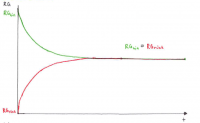
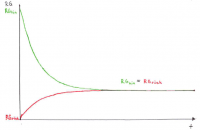
Herleitung Schritt-für-Schritt
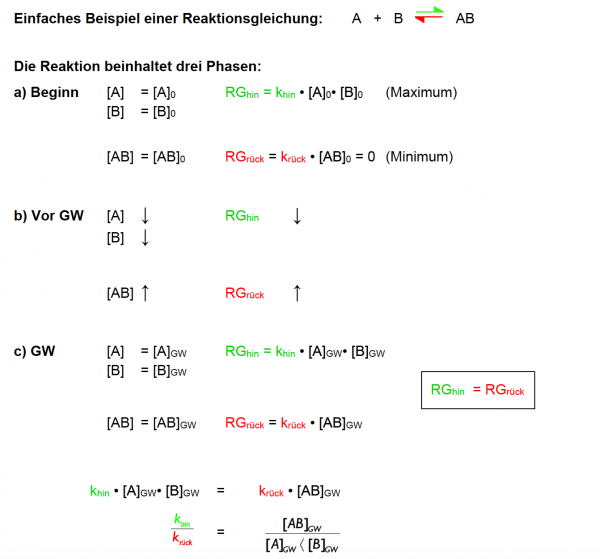
Es ist nötig, das chemische Gleichgewicht mathematisch-quantitativ zu beschreiben, um berechnen zu können, wie groß die Konzentrationen der beteiligten Stoffe im Gleichgewicht sind (z.B. für pH-Wert). Im Kontext der Powerpoint Apfelschlacht wird dies durch die Gleichung RG = f(k, c) verdeutlicht, wobei im Gleichgewichtszustand gilt: RGhin = RGrück.
Aussage: Im Zustand des chemischen Gleichgewichts sind die Konzentrationen aller Stoffe konstant, und können mathematisch berechnet werden: Das (mathematische) Produkt der Produktkonzentrationen durch das Produkt der Eduktkonzentrationen ist konstant.
Da khin und krück konstant sind, können sie als neue Konstante zusammengefasst werden --> K: Gleichgewichtskonstante
Massenwirkungsgesetz:
Graphische Darstellungen
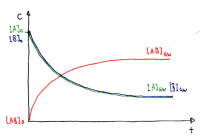
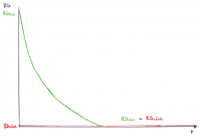
• Die Gleichgewichtskonzentrationen sind je nach Reaktion verschieden und werden durch K beschrieben.
• Es ist auch möglich, dass die Gleichgewichtskon-zentration der Edukte grösser ist als der Produkte
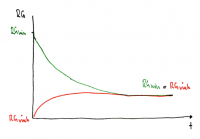
• Die Grösse der Reaktionsgeschwindigkeit im Gleichgewicht wird ebenfalls durch K beschrieben.
• Die Abnahme von RGhin ist der Abnahme der Eduktkonzentrationen proportional.
Beispiele
4. Grundstruktur der Reaktionsgleichung
Betrachten wir eine allgemeine reversible chemische Reaktion:
- aA + bB ⇌ cC + dD
Hierbei sind:
- A und B die Reaktanten,
- C und D die Produkte,
- a, b, c und d die stöchiometrischen Koeffizienten der jeweiligen Spezies (Elemente, Moleküle, Ionen etc.).
Im Gleichgewicht bleibt die Konzentration der Reaktanten und Produkte konstant, obwohl die Hin- und Rückreaktionen weiterhin stattfinden.
5. Die Gleichgewichtskonstante
Einleitung
Die Gleichgewichtskonstante K ist ein zentrales Konzept in der Chemie, das das Verhältnis der Konzentrationen von Produkten zu Reaktanten im chemischen Gleichgewicht beschreibt. Sie liefert wichtige Informationen über die Lage des Gleichgewichts und die Ausbeute einer chemischen Reaktion.
Chemische Bedeutung der Gleichgewichtskonstanten K
| K-Wert | Beschreibung | Zusätzliche Info | Graphische Darstellung |
|---|---|---|---|
| Kmax → ∞ | Es gibt nur noch Produkte | Beim Reaktionstyp ∆H < 0, ∆S > 0 | |
| K > I | Die Produkte überwiegen | Das Gleichgewicht liegt rechts | |
| K = I | Produkte und Edukte halten sich die Waage | Das Gleichgewicht liegt in der Mitte | |
| K < I | Die Edukte überwiegen | Das Gleichgewicht liegt links | |
| Kmax → 0 | Die Edukte reagieren gar nicht | Beim Reaktionstyp ∆H > 0, ∆S < 0 |
6. Zusammenfassung des Videos "Was sagt der Kc-Wert aus?"
Das Video erklärt die Bedeutung des Gleichgewichtskonstantenwertes Kc in chemischen Reaktionen. Hier sind die wichtigsten Punkte:
1. Definition von K:
- K ist das Verhältnis der Konzentrationen der Produkte zu den Reaktanten im Gleichgewicht.
- Für die Reaktion: aA + bB ⇌ cC + dD lautet die Formel:
- K = [C]c · [D]d ÷ [A]a · [B]b
2. Interpretation des Kc-Wertes:
- K > 1: Das Gleichgewicht liegt rechts, auf der Seite der Produkte. Es bedeutet, dass im Gleichgewicht mehr Produkte als Reaktanten vorhanden sind.
- K < 1: Das Gleichgewicht liegt links, auf der Seite der Reaktanten. Es bedeutet, dass im Gleichgewicht mehr Reaktanten als Produkte vorhanden sind.
- K ≈ 1: Die Konzentrationen der Reaktanten und Produkte sind im Gleichgewicht etwa gleich.
3. Einflussfaktoren:
- Temperatur: Eine Änderung der Temperatur kann den Kc-Wert beeinflussen und das Gleichgewicht verschieben.
- Exotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Reaktanten (verringert Kc).
- Endotherme Reaktionen: Erhöhung der Temperatur verschiebt das Gleichgewicht zu den Produkten (erhöht Kc).
4. Zusätzliches:
- [Druck]: Bei Reaktionen mit gasförmigen Reaktanten und Produkten kann eine Druckänderung das Gleichgewicht beeinflussen.
- Konzentration: Änderungen der Konzentrationen der Reaktanten oder Produkte verschieben das Gleichgewicht nach dem [Prinzip von Le Chantelier].
- [Katalysatoren]: Katalysatoren erhöhen die Geschwindigkeit der Hin- und Rückreaktionen, ohne die Lage des Gleichgewichts oder den Wert von Kc zu ändern.
Quellen
- Eigene Notizen