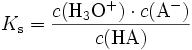Berechnen und Messen des pH-Werts
pKS- und pKB-Wert
Der pKS gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante KS, welche sich folgendermassen berechnet:
Der pKS-Wert ist somit die Stärke der Säure gegenüber Wasser. HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt, weshalb wird sich noch beim Kapitel des pH-Wertes zeigen. Man sieht hier also, dass bei einem hohen KS-Wert die Konzentration an Edukten sehr niedrig ist.
Je tiefer der pKS-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pKB-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pKS+pKB=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat.