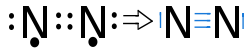Einfache Moleküle
Als einfache Moleküle verstehen wir eine durch Elektronenpaarbindung (A Elektronepaarbindung) entstande Bindung zwischen zwei gleichen Nichtmetallen (siehe Wichtige Nichtmetall-Elemente), welche folglich auch eine symetrische Ladungsverteilung aufweisen→ unpolare Bindung.
Inhaltsverzeichnis
Voraussetzungen für eine solche Bindung
- verschiedene Spins
- Anziehungskräfte durch Coulombkräfte (Coulombgesetz)
- gemeinsame, bindende Elektronenwolke
→ folgende Bindungen kommen dafür in Frage:
Das Wasserstoffmolekül H2
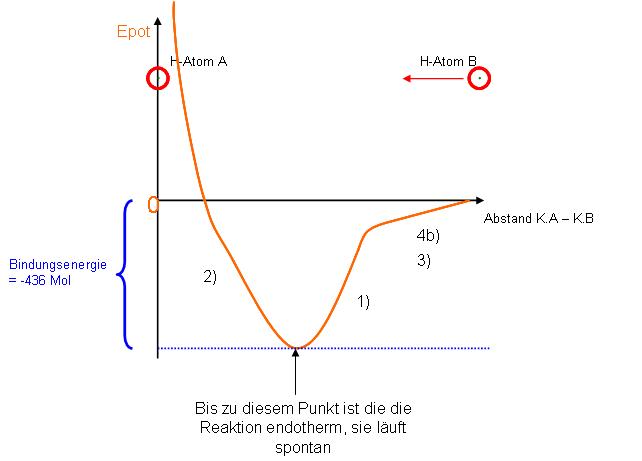
Kräfte zwischen den H-Atomen
1. Kern A-Elektron B / Kern B-Elektron A → Coulombkräfte wirken anziehend
2. Kern A-Kern B → Coulombkräfte wirken abstossend
3. Elektron A-Elektron B → Coulomkräfte wirken abstossend
- Elektron A-Elektron B → magnetische Kraft → 4.
4. a) Spinkombination ↑ ↑ ist abstossend
- b) Spinkombination ↑ ↓ ist anziehend
Epot bei Wasserstoffmolekülbildung
Am Anfang überwiegen die Anziehungskräfte ( 4b und je näher sich die Atome kommen auch 1) dabei sinkt die potentielle Energie, Energie wird frei, die Reaktion läuft spontan. Doch dann beim unteren Ende der Kurve überwiegen jetzt die Abstossungskräfte insbesondere die der Kerne (2), ab jetzt müsste man für eine Annäherung der beiden Atome Energie aufwenden, läuft nicht mehr spontan. Deshalb pendelt sich der Abstand zwischen den beiden Atomen bei eben diesem Tiefpunkt von Epot ein (bei 74 picometer Abstand).
H• + •H = H-H (H↑↓H) → Sp3-Hybridisierung (kein P-Orbital →Orbitale)
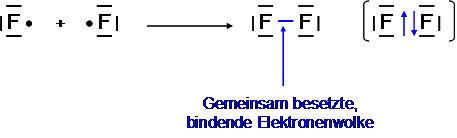
Das Fluormolekül F2
→ Sp3-Hybridisierung (kein P-Orbital)
Das Sauerstoffmolkül O2
→ Sp2-Hybridisierung (ein schwaches P-Orbital , deshalb sind Doppelbindungen reaktionsfreudiger)
Das Stickstoffmolekül N2
→ Sp-Hybridisierung ( zwei schwache P-Orbitale → sehr reaktionsfreudig, instabil)
Quellen
-Chemie-Unterricht Notizen
-Graphics made by Urs Wegmann
-Chemsketch (animierte GIFs)