Anwendungen: "Kalkerosion und Kalkkreislauf"
Inhaltsverzeichnis
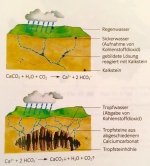
Der Kalkkreislauf in der Natur
Wenn der Untergrund in der Natur aus Kalk besteht, hat es häufig Spalten und Höhlen im Gestein, welche durch die Umwandlung des Calciumcarbonates (Kalk) in das leichtere Calciumhydrogencarbonat entstehen. Diese Reaktion findet statt, wenn CO2-haltiges Regenwasser in das Gestein eindringt. Das Regenwasser nimmt auf dem Weg durch die Luft Kohlenstoffdioxid auf und beim Eindringen in den Boden entstehen die Furchen, da Calciumhydrogencarbonat durch das geringere Gewicht weniger Platz einnimmt.
Die Reaktionsgleichung dieser Gleichgewichtsreaktion sieht folgendermassen aus:
Ca(HCO3)2(aq) ⇌ CaCO2(s) + H2O(l) + CO2(g)
Tropfsteinhöhlen
Genau durch diesen Vorgang entstehen Tropfsteinhöhlen. Wenn ein Wassertropfen die Decke einer Höhle erreicht, entweicht das CO2) in die Höhle, da diese einen Mangel an CO2 hat und eine Verschiebung des Gleichgewichts innerhalb der obigen Gleichung führt dazu, dass es eine Kalkablagerung an der Decke der Höhle entsteht. Solche Ablagerungen entwickeln sich zu den sogenannten Stalaktiten. Derselbe Vorgang kann sich am Höhlenboden abspielen, wenn ein Wassertropfen zu Boden fällt, bevor das CO2 entweicht, die vom Boden herausragenden Kalkgebilde werden Stalagmiten genannt. Die Ablagerungen wachsen jährlich um circa 0,2 mm.
Wie findet man heraus, wo das Gleichgewicht in der Gleichung liegt?
Das Gleichgewicht ist immer bestimmbar, wenn der CO2-Gehalt bekannt ist. Dieser ist abhängig von der Wasserhärte. Beispielsweise Pflanzen haben einen tiefen Kohlenstoffdioxidgehalt durch die Photosynthese, weshalb das Gleichgewicht links liegt. Seen haben folglich weiches Wasser, da durch die Algenpflanzen das Gleichgewicht links gehalten wird.
Allgemein kann gesagt werden:
CO2-Wert tief - Gleichgewicht links - weiches Wasser (geringer Kalkgehalt) - Kalkablagerungen
CO2-Wert hoch - Gleichgewicht rechts - hartes Wasser (hoher Kalkgehalt) - keine Kalkablagerungen
Zweiter Untertitel
Als Beispiel: So wird ein Link innerhalb des Wikis gemacht:
Hier gehts zu den I Grundlagen
Und so wird ein Link innerhalb des Kapitels der eigenen Seite gemacht: Link auf das Kapitel "Weblinks": Hier geht's zu den Weblinks
zweiter Unteruntertitel
So wird eine chemische Formel geschrieben: (H2SO42-).
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
Source-Code:
Der Source Code sieht dan wiefolgt aus: Dies ist das Template mit dem Sie alle arbeiten können:
Ein Text vor dem ersten Titel wird oberhalb des Inhaltsverzichnisses angezeigt == Erster Titel == Hier gibt's ein Bild: [[image:Molmod_ak.gif|thumb|right|Bild eines Antikörpers; für eine detailliertere Sicht siehe [http://swisseduc.ch/chemie/molmod/anwendungen/antikoerper/]]] === Erster Untertitel === So wird ein Link inerhalb des Wikis gemacht: Hier gehts zu den [[I Grundlagen]] ==== Erster Unteruntertitel ==== So wird eine chemische Formel geschrieben: (H<sub>2</sub>SO<sub>4</sub><sup>2-</sup>). == Zweiter Titel == Pfeil: → Gleichgewichtspfeil: ⇌ == Quellen == * Chemieunterlagen == Weblinks == * [http://swisseduc.ch/chemie/ Swisseduc] – Unterrichtsserver für Chemie * [http://meta.wikimedia.org/wiki/Help:Contents#For_editors Mediawiki Hilfeseite] – So kann der Link näher beschrieben werden