Masse und Grösse der Atome
Die Masse der Atome kann nicht mit einer Waage oder mit Hilfe der Gravitationskraft bestimmt werden, da sie zu klein zu leicht sind. Eine Alternative ist notwendig. Auf Grund der Trägheit der Atome, kann die Masse mit dem Massenspektrometer bestimmt werden.
Inhaltsverzeichnis
Massenspektrometer
Wie kann man die Masse von Atomen bestimmen? Mit einer Waage oder mit Hilfe der Gravitationskraft ist dies nicht möglich, die Atome sind viel zu klein und zu leicht. Die Masse von Atomen wird mit einem Massenspektrometer bestimmt.
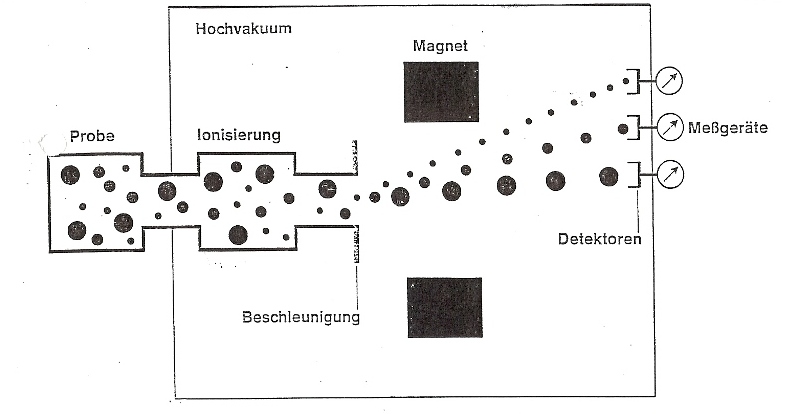
Unsere Teilchen, von welchen wir die Masse bestimmen wollen, bilden die Probe. Im linken Kasten wird diese verdampft und gelangt in den mit „Ionisierung“ beschrifteten Kasten. Durch Beschuss von energiereichen Elektronen, werden unsere Teilchen in positiv geladene Molekül-Ionen umgewandelt, weil beim Zusammenstoß der Elektronen mit unseren Teilchen ein Elektron herausgeschlagen wird. Ein Teil zerfällt aber auch in Bruchstücke. Durch ein elektrisches Feld werden die Ionen beschleunigt, zu einem feinen Strahl gebündelt und durch ein Magnetfeld geschickt. Je nach Masse werden die Ionen dort mehr oder weniger stark aus ihrer Richtung abgelenkt und von Detektoren aufgefangen. Die leichten Teilchen werden bei dieser Prozedur mehr abgelenkt, als die schweren. Dies ist auf die Trägheit zurückzuführen.
Trägheit
Die Trägheit ermöglicht die Bestimmung der Masse von Atomen. (siehe Massenspektrometer) Deshalb ist sie sehr wichtig. Die Trägheit ist die Eigenschaft von Körpern, in ihrem Bewegungszustand zu verharren. Im unseren Beispiel des Massenspektrometers ist dies die gradlinige, gleichförmige Bewegung. Wenn eine externe Kraft auf unsere geladenen Teilchen wirkt, in unserem Beispiel das Magnetfeld, werden diese verschieden abgelenkt. Je kleiner die Masse, je grösser die Ablenkung. Die Gravitationskraft hat hierbei keinen Einfluss auf die Ablenkung.
Mol
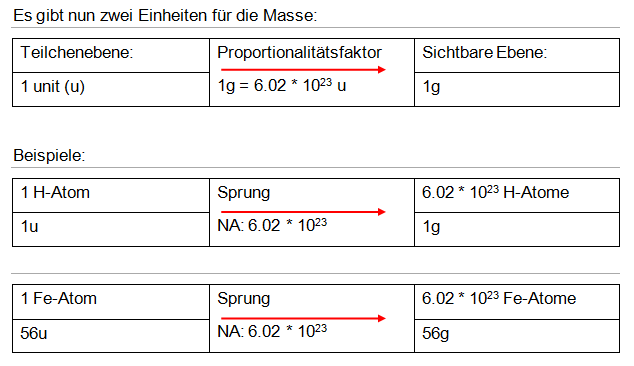
Durch das Massenspektrometer wurde herausgefunden, dass ein H-Atom 1.66 * 10-24g wiegt. Da dies eine sehr kleine Zahl ist, definierte man eine neue Einheit – das Unit. Das heisst 1 unit = 1.66 * 10-24g. Daraus folgt 1g = 6.02 * 1023unit. Diese Konstante nennt man Avogadro-Zahl (NA).
Die Bedeutung des Mols: Es ist möglich, eine definierte Anzahl Teilchen abwägen. Dies ist sehr wichtig, weil es Reaktionen gibt, die nur stattfinden, wenn die richtige Anzahl Teilchen beteiligt ist.
Definition Mol: Ein Mol ist eine Anzahl von Teilchen, und zwar genau 6.02 * 1023 Teilchen. (→ keine Masse!)
Molmasse
Definition Molmasse: Masse von einem Mol Teilchen (6.02 * 1023 Teilchen). Die Einheit ist g/mol.
Bestimmung der Molmasse: Bsp. Wasser H2O → 2 H + 1 O = 2 * 1u + 1 * 16u = 18u → Molmasse = 18 g/mol
Beispiele
Beispiel 1
Aufgabenstellung:
Bestimme die Anzahl Ag-Atome in einem Silberring der Masse 2.66 g.
Lösungsweg:
1. Bestimmung der Molmasse (1 Ag = 108u → 108 g/mol)
2. Dreisatz
6.02 * 1023 Atome = 108g
x Atome = 2.66g
x = 1.5 * 1022 Atome
Beispiel 2
Aufgabenstellung:
Wie viele Teilchen hat es in einem Tropfen Wasser? Die Masse von 10 Tropfen ist 0.42 g. Gib die Lösung in mol und Anzahl Teilchen an.
Lösungsweg:
1. 1 Tropfen = 0.042g
2. 1 Wasserteilchen H2O = 18u (Berechnung weiter oben)
3. → Molmasse = 18g/mol
4. Dreisatz für Berechnung mol
18g = 1mol
0.042g = x mol
x = 0.0023g/mol
5. Dreisatz für Berechnung Anzahl Teilchen
1mol = 6.02 * 1023 Teilchen
0.0023mol = x Teilchen
x = 1.4 * 1021 Teilchen
Beispiel 3
Synthese von Wasser aus den Elementen
Aufgabenstellung:
a) Stelle die Reaktionsgleichung auf.
b) Wie viele Teilchen benötigt die Synthese von einem Liter Wasser?
c) Wie viele Teilchen haben die Edukte?
d) Wie viele Gramm haben die Edukte?
Lösungsweg:
a) 2H2 + O2 → 2H2O
b)
1l Wasser = 1kg = 1000g
1 Wasserteilchen = 18u → Molmasse: 18g/mol
Dreisatz:
18g = 1mol
1000g = xmol
x = 55.6 mol → 3.34 * 1025 Teilchen
c)
H2: 1 * 55.6mol = 55.6mol
O2: 1* 55.6 = 2mol = 27.8mol
d)
H2: Molmasse 1 Teilchen = 2u → 1mol = 2g
Dreisatz:
2g = 1mol
x g = 55.6mol
x = 111.2g
e)
O2: Molmasse 1 Teilchen = 32u → 1mol = 32g
Dreisatz:
32g = 1mol
x g = 27.8mol
x = 889.6g
Atomgrösse
Ein Atom besteht grundsätzlich aus einem Kern und der Hülle. Der Kern ist im Vergleich zur Hülle allerdings winzig klein. Die Hülle hat mit einem Durchmesser von etwa 10-10m einen ungefähr zehntausendfach größeren Durchmesser als der Kern (10-14m). Trotzem befindet sich beinahe die ganze Masse eines Atoms in diesem Kern, da Elektronen viel kleiner sind als Protonen und Neutronen. Diese sind ca. 2000 mal schwerer als Elektronen.
Wäre ein Atomkern so groß wie eine Stecknadel, würde das ganze Atom den Durchmesser des Eifelturmes haben.
Im Periodensystem nimmt die Atomgrösse von links nach rechts ab und von oben nach unten zu. Siehe dazu auch den Artikel C Das Periodensystem
Quellen
- Chemieunterlagen Herr Deuber