D Die fünf Stoffklassen
Diese Seite ist immernoch in der Rekonstruktion => weiterlesen bringt im Moment noch nicht viel, da noch viel fehlt ;-)
Stoffe bestehen aus Teilchen, welche wiederum aus miteinander verbundenen Atomen bestehen. Deshalb unterscheidet man die drei Bindungstypen Elektronenpaarbindung, Ionenbindung und Metallbindung. Diese betrachtet man auf der Teilchenebene. Hingegen werden in diesem Kapitel hier die Stoffe an sich angeschaut, sie werden gemäss ihren Stoffeigenschaften auf der stofflichen Ebene unterschieden. Dabei teilt man die verschiedenen Stoffe in fünf verschiedene Klassen ein...
Inhaltsverzeichnis
Die fünf Stoffklassen
Die flüchtigen Stoffe
- Die Bindungsart bei den flüchtigen Stoffen ist die Elektronenpaarbindung (siehe unter A Elektronenpaarbindung). Die kleinsten Teilchen in der Struktur des Stoffes können entweder polare oder unpolare Moleküle sein. Je nachdem welches von beiden sie sind, ändern sich die Eigenschaften und die weiteren Strukturmerkmale.
Die flüchtigen Stoffe (1)
Die erste "Unterabteilung" der flüchtigen Stoffe sind diejenigen mit unpolaren Molekülen und dementsprechend unpolaren Bindungen.
- Wenn die kleinsten Teilchen in der Struktur unpolar sind, dann sind die Kräfte zwischen diesen Molekülen (ZMK) klein, denn es sind nur schwache Van der Waals-Kräfte vorhanden.
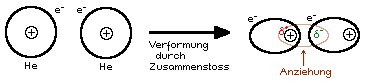
Die Van der Waals-Kraft zur Erinnerung kurz erklärt:
2 Atome bewegen sich ⇒ Zusammenstösse ⇒ Verformung/Kernverschiebung ⇒ vorübergehender Dipol
- Wenn die Anziehungskräfte zwischen Molekülen stark sind, dann sind Schmelz- und Siedepunkt hoch. Da die ZMK hier aber sehr klein sind, sind dementsprechend Schmelz- und Siedepunkt tief.
- "Similia similibus solvuntur" = Die Gleichen werden durch die Gleichen gelöst. Ergo können Stoffe mit unpolaren Molekülen nur in unpolaren Lösungsmitteln gelöst werden.
- Damit ein Stoff elektrisch leitfähig ist, müssen zwei Voraussetzungen erfüllt werden:
- es müssen elektrisch geladene Teilchen vorhanden sein
- diese Teilchen müssen frei beweglich sein
Bei Elektronenpaarbindungen sind jedoch die Valenzelektronen "fest versorgt" und können sich also nicht frei bewegen. Somit sind die flüchtigen Stoffe (1) elektrisch nicht leitend.
- Beispiele für die flüchtigen Stoffe mit unpolaren Molekülen sind Sauerstoff (O2), Methan (CH4) und Wasserstoff (H2).
Die flüchtigen Stoffe (2)
Die zweite "Unterabteilung" der flüchtigen Stoffe sind jene mit polaren Teilchen und somit polaren Bindungen.
- Die ZMK sind stark, denn es gibt zwischen den Teilchen Dipolkräfte und/oder H-Brücken.
- Der Schmelz- und der Siedepunkt sind infolge der stärkeren ZMK höher als bei den flüchtigen Stoffen (1).
- Ebenfalls aufgrund "similia similibus solvuntur" lassen sich die flüchtigen Stoffe (2) nur in polaren Lösungsmitteln lösen.
- Die elektrische Leitfähigkeit besitzen die flüchtigen Stoffe (2) aus dem gleichen Grund wie die flüchtigen Stoffen (1) nicht.
- Beispiele für die flüchtigen Stoffe (2) sind Wasser (H2O) und Ammoniak (NH3).
Die diamantartigen Stoffe
- Die diamantartigen Stoffe enthalten ebenfalls Elektronenpaarbindungen.
- Diamantartige Stoffe haben "Riesenmoleküle" als kleinste Teilchen. Im Falle von Diamant wären das etliche miteinander verbundene Kohlenstoffatome.
- Dadurch dass zum Beispiel Diamant nur aus Kohlenstoffatomen besteht, gibt es zwischen den Teilchen gar keine Kräfte. Denn diese Kohlenstoffatome unterscheiden sich nicht in den Ladungen oder der Grösse oder ähnlichem.
- Der Schmelz- und Siedepunkt bei diamantartigen Stoffen ist sehr, sehr hoch, da es eben riesige Moleküle sind, deren Bindungen aufgespalten werden müssen.
- Diamantartige Stoffe sind nicht löslich.
- Bei den diamantartigen Stoffen sind die Voraussetzungen für elektrische Leitfähigkeit nicht erfüllt. Somit leiten sie nicht.
- Beispiele für diamantartige Stoffe sind Diamant und Quarz (SiO2).
Die hochmolekularen Stoffe
- Auch die hochmolekularen Stoffe enthalten Elektronenpaarbindungen.
- Die kleinsten Teilchen dieser Stoffe sind lange, kettenartige Moleküle.
- Da die kleinsten Teilchen "Ketten" sind, entstehen starke Van der Waals-Kräfte (siehe Abschnitt Van der Waals-Kräfte).
- Der Schmelzpunkt ist relativ hoch, der Siedepunkt ist auch relativ hoch, viele hochmolekulare Stoffe zersetzen sich jedoch, wenn es zu heiss ist.
- Da die hochmolekularen Stoffe unpolar sind, können sie nur in unpolaren Lösungsmitteln gelöst werden.
- Auch bei den hochmolekularen Stoffen sind die Voraussetzungen für die elektrische Leitfähigkeit nicht erfüllt, ergo leiten auch sie nicht.
- Beispiele für die hochmolekularen Stoffe sind Fett oder Kunststoffe wie Nylon, Latex, PET und PVC.
Hier gibt's ein Bild:
So wird eine chemische Formel geschrieben: (H2SO42-).
Zweiter Titel
Pfeil: →
Gleichgewichtspfeil: ⇌
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden