Wichtige Nichtmetall-Elemente
Inhaltsverzeichnis
Wichtige Nichtmetalle
Kohlenstoff
Kohlenstoff (C) kommt in der Natur sowohl in reiner Form als auch chemisch gebunden vor. Aufgrund seiner besonderen Elektronenkonfiguration (halbgefüllte L-Schale) besitzt es die Fähigkeit zur Bildung von komplexen Molekülen und weist von allen chemischen Elementen die größte Vielfalt an chemischen Verbindungen auf. Kohlenstoff ist das Element, das nach Wasserstoff die meisten Verbindungen aller Elemente bilden kann (Wasserstoff steht an erster Stelle, weil die meisten Kohlenstoffverbindungen auch Wasserstoff enthalten). Aufgrund seiner mittelstarken Elektronegativität hat er ein gutes Bindungsvermögen sowohl zu elektropositiveren als auch zu elektronegativeren Elementen. Kohlefasern sind leicht und reisfest und besitzen eine elektrische Leitfähigkeit.
Es existieren zwei verschiedene Modifikationen: Diamant oder Graphit. Dies sind Stoffe, welche zwar aus den selben Atomen bestehen, aber trotzdem verschiedene Eigenschaften aufweisen.
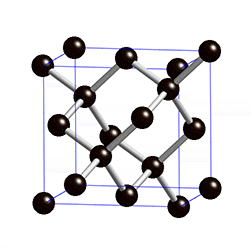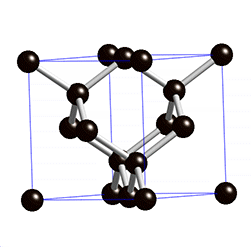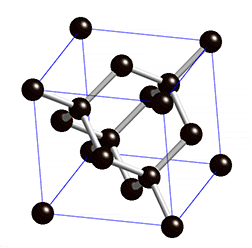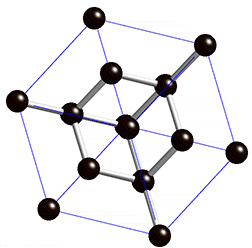
Diamant
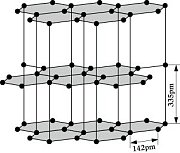
Struktur:
Die Diamant-Struktur hat, wie auf dem Bild erkennbar, eine kubische Form. Jedes Kohlenstoffatom ist tetraedisch mit 4 weiteren Kohlenstoffatomen verbunden.
Eigenschaften:
1. Der Diamant ist extrem hart und hat eine hohe Dichte (3.51g/cm3) → Die Kohlenstoffatome haben durch diese gitterförmige Anordnung einen sehr starken Zusammenhalt.
2. Der Diamant hat einen hohen Schmelzpunkt (3550°C) → Die Moleküle des Diamantes sind extrem gross. Man spricht von sogenannten Riesenmolekülen und je grösser die Moleküle (Teilchen) eines Stoffes sind, desto höher ist dessen Schmelzpunkt.
3. Der Diamant leitet keine Elektrizität → Die Elektronen sind stark gebunden und können sich nicht frei bewegen.
4. Der Diamant ist durchsichtig und kann das Licht stark brechen.
Verwendung:
Als Werkzeug zum Schneiden, Schleifen, Bohren, Fräsen etc.
Als Schmuck sehr begehrt. Seine Fähigkeit, dass Licht zu brechen, macht ihn besonders Wertvoll
Wird der Diamant zum Schmelzen gebracht ensteht Graphit.
Graphit
Struktur:
Graphit ist schwarz und absorbiert das Licht. Es hat eine regelmässige Strukur und ist ähnlichg wie die Kohle, nur dass es keine "Klümpchen" hat. Es hat eine viel kleinere Dichte als der Diamant. Die Ebenen untereinander sind nur locker über Van-der-Waals-Kräfte gebunden.Im Gegensatz zum Diamanten leitet es, weil sich die Valenzelektronen frei bewegen können.
Jedes C-Atom hat 3 Elektronenpaarbindungen.Auf Grund der Riesenmolekülen hat es einen sehr hohen Schmelzpunkt(4000°C).
Beispiele:
Bleistifte, Eishockey-Stöcke, Kohlentabletten, Eloktrolyse
Phosphor
Für Phosphor gibt es 2 Modifikationen:
Weisser Phosphor
Weißer Phosphor ist die flüchtigste und reaktivste Modifikation des Phosphors. Er ist durchscheinend und wachsartig. In fein verteiltem Zustand entzündet sich weißer Phosphor an der Luft von selbst.
Mehrstündiges Erhitzen von weißem Phosphor auf etwa 260 °C unter Luftabschluss führt zu rotem Phosphor
Roter Phosphor
Der rote Phosphor ist schichtweise angeordnet (wie Graphit).
Halogene
Als Halogene bezeichnet man die Nichtmetalle der 7.Hauptgruppe gleich vor den Edelgasen. Ihnen fehlt nur noch ein Elektron zur vollen Valenzschale weshalb sie sehr reaktionsfreudig sind. Die Halogene bilden sehr häufig Salze in Verbindung mit Metallen (Halogene = Salzbildner), weshalb sie in der Natur nicht in elementarer Form vorzufinden sind.
Zu den Halogenen gehören Fluor, Chlor, Brom, Iod und Astat (siehe Übersicht).Die Reaktionsfreudigkeit, beziehungsweise die Ionisierungseneregie und die Elektronegativität (siehe polare Bindung) ist bekanntlich rechtsoben im Periodensytem am grössten, also bei Fluor welches das Element mit den stärksten Anziehungskräften ist. Mit zunehmendere Schallenanzahl sinkt diese Anziehungskraft und somit auch die Reaktionsfreudigkeit von Fluor nach Astat immer mehr.
Edelgase
Als Edelgase werden die Elemente der 8. Hauptgruppe des Periodensystems bezeichnet. Es sind die Elemente: Helium, Neon, Argon, Krypton, Xenon und Radon. Alle Edelgase sind farb- und geruchlose, nicht brennbare und kaum wasserlösliche Gase.
Ihre Atome weisen in der Außenschale acht Elektronen auf. Eine Ausnahme dabei ist Helium, das nur zwei Elektronen in der Außenschale besitzt; da die erste Schale nicht mehr Elektronen binden kann, hat das Atom trotzdem ebenfalls die höchstmögliche Anzahl an Außenelektronen. Edelgase erfüllen als einzige alleinstehende Atome die Oktettregel, was zur Folge hat, dass sie reaktionsunfähig sind.
Beispiele:
Xenon-Leuchten (weil sie nicht reagieren)
Quellen
- Chemieunterlagen