Aufbauprinzip der Elektronenhülle: Unterschied zwischen den Versionen
Kim (Diskussion | Beiträge) (→Das Energiediagramm) |
Kim (Diskussion | Beiträge) (→Die Hund‘sche Regel) |
||
| Zeile 92: | Zeile 92: | ||
==== Die Hund‘sche Regel ==== | ==== Die Hund‘sche Regel ==== | ||
| − | + | [[Bild:Hundscheregel.JPG|thumb|Energiediagramm]] | |
Bei der Besetzung von energiegleichen Orbitalen, also von Orbitalen die sich in | Bei der Besetzung von energiegleichen Orbitalen, also von Orbitalen die sich in | ||
Version vom 11. Mai 2009, 11:52 Uhr
Die Elektronenhülle wird auch Atomhülle genannt. Alle in der Chemie wichtigen Eigenschaften hängen vom Aufbau der Elektronenhülle ab. Denn bei einer chemischen Reaktion gibt es einzig eine Veränderung der äussersten Elektronen, im Atomkern passiert nichts.
Inhaltsverzeichnis
Das Aufbauprinzip der Elektronenhülle
Das Energiediagramm
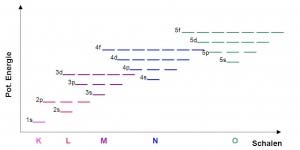
Schalen
MUSS NOCH KORRIGIERT WERDEN
Elektronen können um den Atomkern nur in bestimmten Energiestufen existieren. Wir nennen diese Stufen Spähren oder Schalen. In einer Schale können sich mehrere Elektronen aufhalten. Die verschiedenen Schalen werden, vom Atomkern nach aussen, als K, L , M, N und O-Schalen bezeichnet.
Die Vorstellung, dass sich die Elektronen in Kreisbahnen um den Atomkern bewegen ist falsch. Man nimmt heute an, dass es Raumbereiche sind, in denen sich die Elektronen aufhalten.
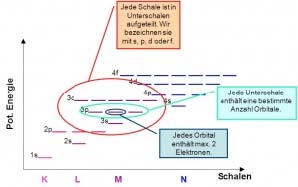
Unterschalen
Dieses Schalennmodell ist aber für grössere Atome mit mehrern Elektronen nicht ausreichend. Die Schalen können in weitere Unterschalen aufgeteilt werden. Diese Unterschalen werden als s, p, d und f-Unterschalen bezeichnet.
Orbitale
MUSS NOCH KORRIGIERT WERDEN
Die Unterschalen können weiter noch in Orbitale aufgeteilt werden. Pro Orbital sind maximal zwei Elektronen vorhanden. Die s-Unterschale besitzt nur ein Orbital. In der p-Unterschale sind es drei Orbitale, in der d-Unterschale 5 und in der f-Unterschale 7 Orbitale. Jede Elektronenhülle besteht also mindestens aus der K-Schale mit der 1s-Unterschale und dem 1s-Orbital mit mindestens einem Elektron. Dies ist der Fall beim Wasserstoffatom.
Die K-Schale besteht nur aus der 1s-Unterschale mit dem s-Orbital. In der L-Schale kommt zur 2s-Unterschale, mit dem s-Orbital, noch die 2p-Unterschale, mit den drei p-Orbitalen, dazu. In der M-Schale kommt zusätlich noch die 3d-Unterschale mit den fünf d-Orbitalen dazu und schliesslich besteht die N-Unterschale zusätzlich noch aus sieben f-Orbitalen in der 4f-Unterschale.
Überlappung der Unterschalen
MUSS NOCH KORRIGIERT WERDEN
Der Energieabstand zwischen den Schalen wird mit zunehmendem Abstand zum Kern immer geringer. Dies führt dazu, dass sich die Schalen überschneiden: Bei der M-Schale haben wir eine s-, eine p- und eine d-Unterschale. Die 3d-Unterschale liegt aber energetisch höher als die 4s-Unterschale. Da Elektronen ja bekanntlich immer zuerst die Orbitale besetzen, die am wenigsten Energie benötigen, wird das 4s-Orbital der N-Schale besetzt bevor die 3d-Unterschale der M-Schale aufgefüllt wurde. Dies führt dazu, dass in der äussersten Schale maximal 8 Elektronen vorkommen können, welche sich immer in der s- und p-Unterschale befinden.
Diese 8 Aussenelektronen oder auch Valenzelektronen sind nicht so stark gebunden wie die Elektronen in den inneren Unterschalen und sind somit von Bedeutung bei chemischen Reaktionen.
Aufbaugesetze
Im Wesentlichen gibt es bei der Verteilung der Elektronen auf die Elektronenhülle drei Grundprinzipien die zu beachten sind:
- Energieprinzip
- Pauliprinzip
- Hund‘sche Regel
Das Energieprinzip
MUSS NOCH ÜBERARBEITET WERDEN
Alle Elektronen werden vom Atomkern angezogen. Jene die näher beim Kern sind, werden stärker angezogen und sind energieärmer. Dies entspricht der Regel der Coulomb-Kraft: F=(Q1*Q2)/r2
Die äusseren Elektronen sind energiereicher und werden nicht so stark vom Kern angezogen. Trotz der Anziehungskräfte fallen sie nicht in den Kern. Grund dafür ist der Wellencharakter der Elektronen. Elektronen können sich nur in bestimmten Feldern um den Atomkern bewegen, die ihrem Energiezustand entsprechen. Dieser Zustand ermöglicht eine positive Interferenz, welche Voraussetzung für eine stabile Lage ist. Diese Orte mit der grössten Aufenthalts-Wahrscheinlichkeit sind die Orbitale.
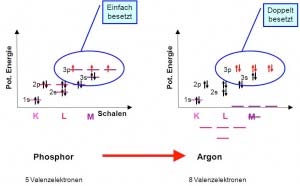
Das Pauliprinzip
Das Pauliprinzip besagt, dass pro Orbital maximal zwei Elektronen mit umgekehrtem Spin vorhanden sein können. Der „Spin“ der Elektronen lässt sich als Drehung des Elektrons, um die eigene Achse deuten. Befinden sich zwei Elektronen im gleichen Orbital, so muss der Spin unterschiedlich sein.
Die Hund‘sche Regel
Bei der Besetzung von energiegleichen Orbitalen, also von Orbitalen die sich in der gleichen Unterschale befinden, gibt es folgende Regel: Jedes Orbital wird erst einfach besetzt und erst anschliessend kommt das zweite Elektron dazu. Diese Regel nennt man die Hund’sche Regel. Sie wird durch die gleiche Ladung der Elektronen bestimmt. Wie bekannt, stossen sich gleiche Ladungen ab, weshalb Elektronen versuchen so weit wie möglich voneinander entfernt zu sein. So werden durch diese Abstossung zuerst alle Orbitale einfach besetzt und erst dann aufgefüllt.
Quellen
- Chemieunterlagen
- Elemente; Magyar, Liebhart, Jelinek; öbv&hpt Verlag; 2. Auglage, Nachdruck 2005
- http://www.energiewelten.de/elexikon/lexikon/seiten/htm/020202_Atomhuelle_und_Atomkern_Kernphysik.htm
- http://www.pas-berlin.de/chemie/ch-e1/atombau/atombau.html
- http://www.chempage.de/theorie/atome.htm
- http://www.hamburger-bildungsserver.de/welcome.phtml?unten=/klima/energie/enk-12.html
- http://www.tgs-chemie.de/nebeng5.gif
Weblinks
- Swisseduc (http://swisseduc.ch/chemie/) – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite (http://meta.wikimedia.org/wiki/Help:Contents#For_editors) – So kann der Link näher beschrieben
werden