Kugelwolkenmodell: Unterschied zwischen den Versionen
Cyril (Diskussion | Beiträge) |
Cyril (Diskussion | Beiträge) |
||
| Zeile 18: | Zeile 18: | ||
=== Beispiele zum KWM === | === Beispiele zum KWM === | ||
Hier folgen ein paar Beispiele, an denen man das KWM gut illustrieren und nachvollziehen kann: | Hier folgen ein paar Beispiele, an denen man das KWM gut illustrieren und nachvollziehen kann: | ||
| + | |||
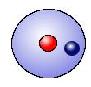
| + | Wasserstoff sowie O<sub>2</sub> | ||
[[Bild:KWM1.JPG]] | [[Bild:KWM1.JPG]] | ||
Version vom 16. Januar 2009, 19:42 Uhr
Das Kugelwolkenmodell wird zur Vereinfachung der Darstellung des Orbitalmodells verwendet. Es zeigt nur die Valenzschalen der jeweiligen Atome, die Elektronen auf den inneren Schalen werden bei diesem Modell vernachlässigt.
Inhaltsverzeichnis
Das Kugelwolkenmodell
Im Kugelwolkenmodell (KWM) geht man davon aus, dass die Elektronen um ein Atom kugelförmige Aufenthaltsorte haben. Jede dieser Wolken können mit ein oder zwei Elektronen belegt werden. Aufgrund der zunehmenden Grösse der Schalen nehmen auch die Kugelwolken zu, wobei nicht alle der Wolken besetzt werden müssen:
* Erste Schale (K-Schale) = bis zu 2 Elektronen = 1 Elektronenwolke * Zweite Schale (L-Schale) = bis zu 8 Elektronen = 4 Elektronenwolken * Dritte Schale (M-Schale) = bis zu 18 Elektronen = 9 Elektronenwolken * Vierte Schale (N-Schale) = bis zu 32 Elektronen = 16 Elektronenwolken
Jedoch nimmt jede äusserste Schale, wie schon im Bohrschen Modell festgelegt, bis auf weiteres nur acht Elektronen auf!
Es gibt ein paar einfache Regeln, durch die das KWM beschrieben werden kann:
- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle!)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt. Erst ab dem 5. Elektron auf der Schale sind die Elektronen paarweise in den Elektronenwolken verteilt.
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.
Beispiele zum KWM
Hier folgen ein paar Beispiele, an denen man das KWM gut illustrieren und nachvollziehen kann:
Wasserstoff sowie O2
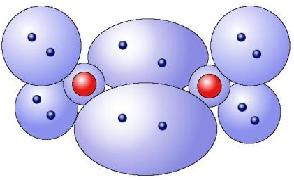
Vergleich: KWM - Orbitalmodell
CYRIL
Die Lewisschreibweise
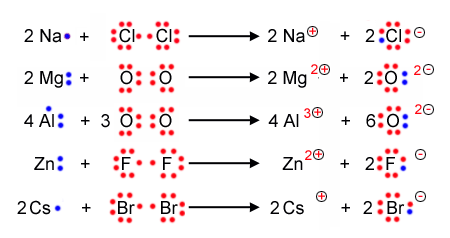
Bei der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wie die Bindungen zwischen Atomen und Molekülen aussehen. Dabei ersetzt man einfach die vollbesetzetn Kugelwolken durch einen Strich und die einfach besetzten Kugelwolken durch einen Punkt.
Beispiele zur Lewisschreibweise
Hier folgen ein paar Beispiele, an denen man die Schreibweie gut illustrieren und nachvollziehen kann:
Quellen
- http://wikipedia.org
- http://google.com
- Heftaufschrieb
- Bilder: Eigenerstellung