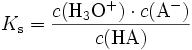Grundlagen: Unterschied zwischen den Versionen
Cyril (Diskussion | Beiträge) |
Cyril (Diskussion | Beiträge) |
||
| Zeile 1: | Zeile 1: | ||
== Säure-Base-Reaktion == | == Säure-Base-Reaktion == | ||
| − | Eine Säure-Base Reaktion ist eine Protonenübergabe, auch Protolyse genannt. Dabei gibt die Säure ein Proton, ein H<sup>+</sup> ab während die Base dieses Proton aufnimmt. Ein H<sup>+</sup> kann jedoch nur abgegeben werden, wenn das Elektron des H sehr stark angezogen ist und das H somit leicht von der Säure getrennt werden kann, d.h. Säuren sind polare Stoffe. Die Säure wird dadurch zu einer Base, die Base wird zu einer Säure. Dadurch wird auch klar, dass jede Säure eine | + | Eine Säure-Base Reaktion ist eine Protonenübergabe, auch Protolyse genannt. Dabei gibt die Säure ein Proton, ein H<sup>+</sup> ab während die Base dieses Proton aufnimmt. Ein H<sup>+</sup> kann jedoch nur abgegeben werden, wenn das Elektron des H sehr stark angezogen ist und das H somit leicht von der Säure getrennt werden kann, d.h. Säuren sind polare Stoffe. Die Säure wird dadurch zu einer Base, die Base wird zu einer Säure. Dadurch wird auch klar, dass jede Säure eine konjugierte Base hat, als auch jede Base eine konjugierte Säure hat, z.B. HNO<sub>3</sub> (Salpetersäure) wird zu NO<sub>3</sub><sup>-</sup> (Nitrat-Ion) und umgekehrt. Manche Stoffe können sowohl eine Säure als auch eine Base sein, diese nennt man Ampholyte, ein wichtiges Beispiel dafür ist H<sub>2</sub>O (wichtig für pH-Wert). Wie die Reaktion abläuft, hängt vom Reaktionspartner ab. Denn: Es reagiert immer die stärkste Säure mit der stärksten Base. So wird Wasser, wenn es mit einer starken Säure reagiert zu einer Base und es entsteht H<sub>3</sub>O<sup>+</sup> (siehe dazu [[Der pH-Wert]]). |
Die meisten Säuren sind ausserdem in Wasser gelöst und somit dort eigentlich gar nicht vorhanden, da sie mit dem Wasser reagieren und H<sub>3</sub>O<sup>+</sup> als Säure entsteht. Säure-Base-Reaktionen sind Gleichgewichtsreaktionen, das Gleichgewicht liegt jeweils bei der schwächeren Säure und der schwächeren Base, d.h. der grösste Teil der stärkeren Säure bzw. Base reagieren. | Die meisten Säuren sind ausserdem in Wasser gelöst und somit dort eigentlich gar nicht vorhanden, da sie mit dem Wasser reagieren und H<sub>3</sub>O<sup>+</sup> als Säure entsteht. Säure-Base-Reaktionen sind Gleichgewichtsreaktionen, das Gleichgewicht liegt jeweils bei der schwächeren Säure und der schwächeren Base, d.h. der grösste Teil der stärkeren Säure bzw. Base reagieren. | ||
| − | Einige Säuren und ihre | + | Einige Säuren und ihre konjugierten Basen: |
{| | {| | ||
| Zeile 23: | Zeile 23: | ||
| Essigsäure: CH<sub>3</sub>COOH || Acetat-Ion: CH<sub>3</sub>COO | | Essigsäure: CH<sub>3</sub>COOH || Acetat-Ion: CH<sub>3</sub>COO | ||
|} | |} | ||
| − | Die Essigsäure gehört zu der Gruppe der organischen Säuren, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (O<sub>2</sub>CH), der Rest variert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die | + | Die Essigsäure gehört zu der Gruppe der organischen Säuren, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (O<sub>2</sub>CH), der Rest variert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. |
Basen können auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup>). Dies ist jedoch nicht das Kalk, das wir in unserem Wasser finden, sondern eine Verbindung aus Hydrogencarbonat und Calcium, die dadurch entsteht, dass Kalk mit Kohlensäure reagiert: | Basen können auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca<sup>2+</sup>CO<sub>3</sub><sup>2-</sup>). Dies ist jedoch nicht das Kalk, das wir in unserem Wasser finden, sondern eine Verbindung aus Hydrogencarbonat und Calcium, die dadurch entsteht, dass Kalk mit Kohlensäure reagiert: | ||
| Zeile 63: | Zeile 63: | ||
HA+H<sub>2</sub>O⇌H<sub>3</sub>O<sup>+</sup>+A<sup>-</sup> [[Bild:pks.jpg]]. | HA+H<sub>2</sub>O⇌H<sub>3</sub>O<sup>+</sup>+A<sup>-</sup> [[Bild:pks.jpg]]. | ||
| − | HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt. Man sieht hier also, dass bei einem hohen K<sub>S</sub>-Wert die Konzentration an Edukten | + | HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt. Man sieht hier also, dass bei einem hohen K<sub>S</sub>-Wert die Konzentration an Edukten sehr niedrig ist. |
| − | Je tiefer der pK<sub>S</sub>-Wert, desto stärker die Säure. Dasselbe gilt auch für den pK<sub>B</sub>-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem | + | Je tiefer der pK<sub>S</sub>-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pK<sub>B</sub>-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pK<sub>S</sub>+pK<sub>B</sub>=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. |
Version vom 16. Januar 2009, 16:57 Uhr
Inhaltsverzeichnis
Säure-Base-Reaktion
Eine Säure-Base Reaktion ist eine Protonenübergabe, auch Protolyse genannt. Dabei gibt die Säure ein Proton, ein H+ ab während die Base dieses Proton aufnimmt. Ein H+ kann jedoch nur abgegeben werden, wenn das Elektron des H sehr stark angezogen ist und das H somit leicht von der Säure getrennt werden kann, d.h. Säuren sind polare Stoffe. Die Säure wird dadurch zu einer Base, die Base wird zu einer Säure. Dadurch wird auch klar, dass jede Säure eine konjugierte Base hat, als auch jede Base eine konjugierte Säure hat, z.B. HNO3 (Salpetersäure) wird zu NO3- (Nitrat-Ion) und umgekehrt. Manche Stoffe können sowohl eine Säure als auch eine Base sein, diese nennt man Ampholyte, ein wichtiges Beispiel dafür ist H2O (wichtig für pH-Wert). Wie die Reaktion abläuft, hängt vom Reaktionspartner ab. Denn: Es reagiert immer die stärkste Säure mit der stärksten Base. So wird Wasser, wenn es mit einer starken Säure reagiert zu einer Base und es entsteht H3O+ (siehe dazu Der pH-Wert). Die meisten Säuren sind ausserdem in Wasser gelöst und somit dort eigentlich gar nicht vorhanden, da sie mit dem Wasser reagieren und H3O+ als Säure entsteht. Säure-Base-Reaktionen sind Gleichgewichtsreaktionen, das Gleichgewicht liegt jeweils bei der schwächeren Säure und der schwächeren Base, d.h. der grösste Teil der stärkeren Säure bzw. Base reagieren.
Einige Säuren und ihre konjugierten Basen:
| Salpetersäure: HNO3 | Nitrat-Ion: NO3- |
| Kohlensäure: H2CO3 | Hydrogencarbonat-Ion: HCO3- |
| Hydrogencarbonat: HCO3- (Ampholyt!) | Carbonat-Ion: CO32- |
| Phosphorsäure: H3PO4 (daraus:H2PO4- und H1PO42-, Ampholyte) | Phosphat-Ion: PO43- |
| Oxonium: H3O+ | Wasser: H2O |
| Wasser: H2O | Hydroxid-Ion: OH- |
| Hydroxid-Ion: OH- | Oxid-Ion: O 2- |
| Essigsäure: CH3COOH | Acetat-Ion: CH3COO |
Die Essigsäure gehört zu der Gruppe der organischen Säuren, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (O2CH), der Rest variert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. Basen können auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca2+CO32-). Dies ist jedoch nicht das Kalk, das wir in unserem Wasser finden, sondern eine Verbindung aus Hydrogencarbonat und Calcium, die dadurch entsteht, dass Kalk mit Kohlensäure reagiert:
Ca2+CO32-+H2CO3→Ca2+(HCO3-)2
Reaktionstypen
Neutralisation:
Eine Base und eine Säure neutralisieren sich gegenseitig. Typisch hierfür ist die Reaktion von OH--Ionen mit starken Säuren, denn dadurch entsteht Wasser und eine schwache Base, welche beide nicht besonders stark sind und deshalb auch praktisch nicht miteinander reagieren.
HCl+Na+OH-→H2O+Na+Cl-
Die starke Säure vertreibt die schwache Base aus ihrem Salz:
K+CN-+HClaq⇌K+Claq-+HCN
Kalknachweis:
Wenn aus Kohlensäure (H2CO3) ein Carbonat-Ion (CO32-) entsteht, so kann man dies auch in der Geologie verwenden. CO32- kann mit Ca2+ reagieren und es entsteht Kalk Ca2+CO32-. Dies kann man dann mit einer starken Säure reagieren lassen, zum Beispiel HCl:
Ca2+CO32-+2HClaq⇌H2CO3+Ca2+Cl2-
Basen im Wasser
NH3+H2O⇌NH4++OH-
Dies wird auch später wichtig sein um den pOH (Gegenstück des pH-Wertes) zu bestimmen, da dies in der Anzahl OH--Ionen gemessen wird. Logischerweise hat es mehr OH-, wenn es auch mehr Base hat.
pKS- und pKB-Wert
Der pKS gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante KS, welche sich folgendermassen berechnet:
HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt. Man sieht hier also, dass bei einem hohen KS-Wert die Konzentration an Edukten sehr niedrig ist.
Je tiefer der pKS-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pKB-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pKS+pKB=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat.
Quellen
Text: eigene Notizen
Bild: Wikipedia