Bedeutung der ZMK: Unterschied zwischen den Versionen
| Zeile 89: | Zeile 89: | ||
Unpolare Bindung, schwache [http://mobile.kanti-baden.ch/wiki/index.php?title=A_Elektronenpaarbindung&action=edit EPB]. ZMK-Kategorie, intramolekulare Kräfte! | Unpolare Bindung, schwache [http://mobile.kanti-baden.ch/wiki/index.php?title=A_Elektronenpaarbindung&action=edit EPB]. ZMK-Kategorie, intramolekulare Kräfte! | ||
| − | '''Salzbrücken:''' [http:// | + | '''Salzbrücken:''' [http://chemiewiki.kanti-baden.ch/Grundlagen_der_Ionenbindung Ionenbindungen], welche das Protein ebenfalls sehr stark stabilisieren. |
'''Wasserstoffbrücken:'''Sind zahlenmässig am wichtigsten. | '''Wasserstoffbrücken:'''Sind zahlenmässig am wichtigsten. | ||
Version vom 5. Januar 2009, 19:16 Uhr
Inhaltsverzeichnis
Die seltsamen Eigenschaften von Wasser
DNS
Proteine
Gesamtüberblick
Definition
Proteine sind durch die Verkettung von Aminosäuren gebildete Makromoleküle und Grundbausteine aller Zellen.
Die AS-Ketten erreichen eine Länge von bis zu mehreren tausend AS, wobei solche mit einer Länge bis zu 100 AS als Peptide bezeichnet werden.
Die Abfolge für die Aminosäuren für ein bestimmtes Protein ist in Form von Genen in der DNS codiert.
Vielfalt
Die Funktion eines Proteins wird durch dessen räumliche Struktur bestimmt. Diese resultiert aus der Abfolge der AS und Länge der Aminosäureketten. Da die Kombinationsmöglichkeiten der AS-Verkettung - schon alleine mit den im menschlichen Körpervorkommenden Aminosäuren - sehr gross sind und somit auch die räumliche Struktur, können Proteine entsprechend ihrer Form die verschiedensten Funktionen erfüllen. Die Aminosäuren untereinander haben wiederum unterschiedliche chemische Eigenschaften, woraus eine weitere Variabilität der AS-Ketten und somit der Form und Funktion von Proteinen entsteht.
Funktion
Proteine erfüllen vielfältige lebenswichtige Funktionen und sind Hauptbestandteil aller Zellen - ob in der Körperabwehr, beim Transport von Stoffen, als Signal-, Membran- und Strukturproteine oder auch Enzyme. Es ist deshalb auch entscheidend, welche Proteine in welcher Konzentration in einer Zelle vorkommen; denn sie bestimmen auch deren Form (Aussehen) und Funktion. Manche spezialisierte Proteine, sogenannte Transkriptionsfaktoren, können sogar die Ablesehäufigkeit bestimmter Gene regulieren und somit die Konzentration eines bestimmten Proteins in einer Zelle verändern.
Peptidbindung
Proteine sind aufgebaut aus - durch Peptidbindung vernetzten - Aminosäuren.
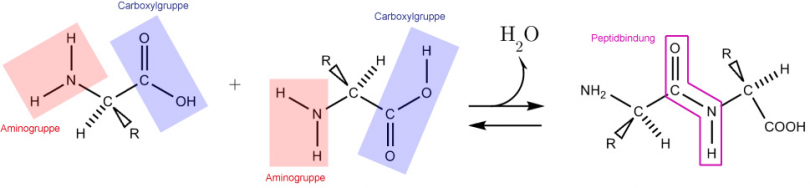
Bindungsschema (Siehe Abb. 1)
Schema der Reaktion (Vernetzung zweier Aminosäuren):
Aminogruppe (NH2) der 1. AS + Carboxylgruppe (COOH) (Säuregruppe) 2. AS
Aminogruppe (NH2) 2. AS + Carboxylgruppe (COOH) (Säuregruppe) 1. AS
Das strukturtypische Merkmal eines Peptids ist die Peptidbindung. Eine Peptidbindung (-CO-NH-) ist eine Bindung zwischen der Carboxylgruppe einer Aminosäure und der Aminogruppe einer zweiten.
Bei der Verbindung der beiden Aminosäuren läuft eine Kondensationsreaktion ab (es findet eine Abspaltung von H2O statt). Die Umkehrung dieser Reaktion wäre eine Hydrolyse. Die treibende Kraft dabei ist ein Abschied; nämlich das Weggehen einesenergiearmen H2O-Moleküls. Das entstandene Peptid besitzt wiederum eine Carboxylgruppe, welche erneut mit einer weiteren Aminosäure eine weitere Peptidbindung eingehen kann. Auf diese Weise entstehen längere Peptide und schliesslich grössere Proteine.
Ein analoges Prinzip zur Peptidbindung bietet die "Brio-Eisenbahn". Aminosäuren werden wie die Wagons aneinandergehängt und kombiniert.
Insgesamt gibt es 20 verschiedene AS, die sich durch ihre Reste (R) unterscheiden. Wenn die Reste gross werden, stören sich diejenigen zweier Aminosäuren. Sind Reste

polar/unpolar (H-Brücken-fähig/-unfähig), so kann entschieden werden, ob sie hydrophil oder hydrophob sind: polare Reste sind hydrophil, unpolare Reste hydrophob (Zur Erinnerung: Wasser ist ein polarer Stoff).
Im Körper wird die Reaktion durch Enzyme - ebenfalls Proteine! - beschleunigt.
Das Grundgerüst der Proteine bildet das Backbone ("Rückgrat mit Füsschen").
Strukturen eines Proteins
Die Funktion eines Proteins ist abhängig von dessen 3D-Struktur. Diese sorgt für die Erfüllung einer für das Protein spezifischen Funktion. Dieses Grundprinzip sollte bei allen Überlegungen zu Proteinen berücksichtigt werden.
Bei der Proteinfaltung während und nach der Proteinbiosynthese erhält das Protein die 3D-Struktur. Zusätzlich helfen Chaperones-Proteine ("Anstandsdamen") den neuen Proteinen, sich korrekt zu falten (die Bezeichnung "Chaperone" wurde gewählt, weil diese unreife Proteine "vor schädlichen Kontakten bewahren"). Zur Veranschaulichung der Strukturen empfehlen wir diese Seite (Voraussetzungen: Internet Explorer + Chime PlugIn).
Oft herrscht Verwirrung über die Einteilung der Kräfte in inter- und intramolekulare Kräfte, die in Sekundär-, Tertiär-, und Quartärstrukturen wirken. Intramolekulare Kräfte wirken innerhalb eines einzelnen Moleküls, intermolekulare Kräfte zwischen zwei Molekülen. Hier ein Überblick der Strukturen:
Primärstruktur
Als Primärstruktur wird die Abfolge der einzelnen Aminosäuren eines Proteins bezeichnet.
Sekundärstruktur
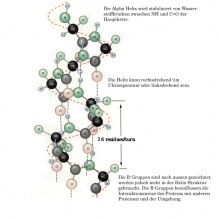
Die Anordnung der Aminosäuresequenzen im Molekül. Die Aminosäuresequenzen werden mit H-Brücken verbunden. Daraus resultieren folgende zwei wichtigen lokalen Struktureinheiten:
α-Helix
Die α-Helix wird durch intramolekulare H-Brücken zwischen den NH- und den CO-Gruppen der Hauptkette stabilisiert. Die CO-Gruppe jeder Aminosäure bildet eine H-Brücke zur NH-Gruppe der Aminosäure.
β-Faltblatt (engl.: β-Sheet)

Zwei AS-Ketten liegen parallel zueinander. Dadurch wird die Bildung intermolekularer (=zwischenmolekularer) H-Brücken zwischen NH- und CO-Gruppen der Peptidbindungen möglich. Eine faltblattartige Struktur entsteht durch diese Kräfte. β-Faltblätter liegen intermolekular oder intramolekular vor. Sie können intermolekular auftreten, wenn zwei AS-Ketten nebeneinander liegen.
Tertiärstruktur
Das fertige Protein in seiner 3D-Form. Die Strukturen entstehen aufgrund intra- und intermolekularer Kräfte durch Wasserstoffbrückenbindungen (und Wechselwirkungen der Aminosäuren). Andere Faktoren bestimmen ebenfalls die spezifische Anordnung im Raum:
Disulfidbrücken: Stärkste Klammern, die das Protein zusammenhalten. Können durch Enzyme geöffnet werden (Abbau Proteine im Magen und Darm). Unpolare Bindung, schwache EPB. ZMK-Kategorie, intramolekulare Kräfte!
Salzbrücken: Ionenbindungen, welche das Protein ebenfalls sehr stark stabilisieren.
Wasserstoffbrücken:Sind zahlenmässig am wichtigsten.
Hydrophobe Wechselwirkungen: Ausschlusskräfte. Umgeben von Wasser werden Bereiche ausgeschlossen, die keine H-Brücken bilden können, von denen, die es können [1]. Nicht H-Brücken- fähige Teile des Proteins bleiben durch Ausschluss zusammen. Intermolekular werden H-Brücken mit dem Wasser gebildet. Wenn ein Protein mit H2O umgeben ist und es eine Kugel bildet, sind die hydrophoben AS innen und hydrophile (weiter) draussen. Die AS-Kette formt sich so, dass unpolare (hydrophobe, H-Brücken-unfähige) Teile möglichst nicht mit dem Wasser in Kontakt kommen, also in der Mitte verbleiben. Es gilt: lipophil = hydrophob = H-Brücken-unfähig und hydrophil = lipophob = H-Brücken-fähig.
So vielfältig die Funktionen der Proteine durch ihre 3D-Struktur sind, so gross ist auch die Formenvielfalt der Tertiärstrukturen [2].
Quartärstruktur
Mehrere fertige Proteine lagern sich zu einem grösseren Proteinkomplex aneinander, der aus Untereinheiten besteht.
Vier Myoglobin-Proteine bilden den Proteinkomplex Hämoglobin (eine Quartärstruktur). Durch die Entwicklung einer Quartärstruktur kann die O2-Versorgung mittels Hämoglobin noch effektiver verlaufen. Hämoglobin wird in roten Blutkörperchen verpackt, welche verschwenderisch verwendet werden, da die O2-Versorgung sehr wichtig ist.
Das Hämoglobin enthält vier Scheiben (Häme). Ein Häm beinhaltet ein Eisenion (Fe2+), an welches sich Sauerstoff (Elektronen-"Gierschlund") binden kann. Ebenfalls enthält das Hämoglobin vier Globine. Die Bindung C-O ist stärker als Fe-O (das Zellgift Kohlenmonoxid würde irreversibel an Hämoglobin gebunden). Das Globin verschiebt die Bindungsstärke zugunsten von Sauerstoff und zu Ungunsten von Kohlenmonoxid (Schutzfunktion). Für eine gute Visualisierung von Hämoglobin ist diese Internetseite geeignet [3].
Das Hämoglobin resp. das Myoglobin nimmt O2 von der Lunge auf [4] und transportiert ihn zu den verbrauchenden Geweben. Mehr Hämoglobin führt zu schnellerer O2-Versorgung. Bei Rauchern ist ein Prozentsatz des Hämoglobins bereits "kaputt", da eine CO-Bindung stattgefunden hat.
Häme können also O2 (starke Bindung) und CO (noch stärkere Bindung) binden.
Beispiel für Nutzen der Quartärstruktur: Hämoglobin

Dass ein Hämoglobin aus vier Hämen und vier Globinen besteht, verschafft einen weiteren Vorteil. Die Bindung von O2 an eine Untereinheit erhöht das Mass für die Bindungsstärke für das O2 der übrigen Untereinheiten (zwischen den Bindungspartnern). Der letzte Sauerstoff wird also am stärksten gebunden. Die anfängliche Steigung der Kurve ist tief, da die Untereinheiten des Hämoglobins unabhängig voneinander um das erste O2 kämpfen. Ein gebundenes O2 Molekül an einer Untereinheit erhöht das Mass für die Bindungsstärke der anderen, was dann zu einer grösseren Steigung führt. Die Quartärstruktur macht Sinn genau dieses Tricks wegen. Wenn alle vier gebunden sind, sind die räumlichen Verhältnisse optimal (Abstände!).
Protein-Denaturierung
Verlust der 3D-Struktur führt unweigerlich zum Verlust der Funktion. Wenn zwei Proteine nach der Denaturierung mit lipophilen Aminosäuren aussen zusammenkommen, können sie verkleben. Verklebung (Klumpen, Verklumpung); es entsteht eine neue Einheit. Viele Krankheiten hängen damit zusammen (Alzheimer, Parkinson, BSE).
Faktoren, die Denaturierung bewirken
Temperatur
Aufgrund der zunehmenden Teilchenbewegung reichen die Kräfte irgendwann nicht mehr aus, um die Struktur beizubehalten. Beispiel: Hat ein Säugling hohes Fieber, so sollte man ihn kühlen. Bei hohen Temperaturen nimmt die Fe-Versorgung ab, was zueiner kleineren Fe-Konzentration führt. Der Körper hat Vorräte, doch die Bakterien werden so ausgehungert. Der Körper hält mehr aus, Bakterien profitieren mehr von höherer Temperatur, da sie schneller wachsen, die Eisenzufuhr jedoch wird aber mit Fieber eingedämmt. Am besten man lässt dem Körper Zeit. Ab einer bestimmten Temperatur aber werden die Proteine im Körper denaturiert! Dies führt oft bei viralen Infekten zum Tode.
Änderung des pH-Wertes (z.B. durch Säuren) und daraus resultierende Veränderung der Eigenschaften von Wasser Hintergrund zu pH-Wert: Es gibt AS, die durch Basen ihre Eigenschaft ändern (von lipophil zu hydrophil, oder umgekehrt). Wenn das passiert, kehren sich zum Teil Teile von innen nach aussen oder umgekehrt. Wiederum ist eine Verklumpung zu beobachten. Bsp.: Pepsin (Verdauungsenzym), das Proteine zerschneidet. Die Form des Proteins ist bei neutralem pH-Wert nicht im Einsatz, erst wenn es in saure Umgebung kommt, wird es aktiviert (wie Sicherung einer Pistole). Wenn der pH-Wert stimmt, beginnen bestimmte Proteine erst zu wirken und nehmen ihre aktive Form an. Milch denaturiert (Flocken), indem sie sauer wird. Säure kann Proteine denaturieren, nachher sind sie verklebt. Wenn Alkohol zur Milch gegeben wird, werden die H-Brücken zwischen Protein und Wasser zu stark gelockert, wiederum findet eine Verklumpung statt. Alkohol (und andere Lösungsmittel) führt dazu, dass weniger H-Brücken eingegangen werden (H-Brücken ausserhalb werden abgeschwächt (lipophiler Fleck kann beispielsweise mit Alkohol gereinigt werden).
Krankheiten durch Protein-Denaturierung: BSE

Zelluläre Prionen und infektiöse Prionen
Prionen sind Proteine, die auf der Aussenseite der Nervenzellen des Gehirns sitzen. Wenn sie durch infektiöse Prionen in schädliche Prionen (PRPsc) umgewandelt werden, können sie Krankheiten auslösen.
PRPsc: Protease resistant protein, sc: scrapie (scrapie-Form)
PRPc: Protease resistant protein, c: cellular (zelluläre Form)
Die Primärstruktur von beiden Prionen ist gleich, doch ihre 3D-Struktur ist verschieden (siehe Abb. 9).
Von Scrapie zu BSE
Scrapie ist eine Krankheit von Schafen, bei welcher diese beginnen, sich blutig zu kratzen und zu torkeln. Ausserdem weisen sie eigenartige Verhaltensweisen auf und sterben schliesslich. Scrapie gibt es schon sehr lange und ist keine Gefahr für uns. Tote Tiere werden aber anschliessend vermahlen und anderen verabreicht (z.B. Kühen als Kraftfutter). Man gibt Rindern also mehlartiges Zusatzfutter tierischen Ursprungs; auch tote Schafe, die an „scrapie“ gestorben sind. Beim Essen von Schafen mit Scrapie geschieht nichts (höhere Säugetiere haben Prionen, die unterschiedlich sind, einige AS anders). Prionen der Rinder sind unseren jedoch ähnlicher. Die infektiösen Proteine können nicht wie andere in unserem Magen durch Prothease bis auf die Aminosäuren zerschnitten werden; diese Eigenschaft macht sie gefährlich. Sie sind resistent gegen Hitze von über 100° C und Säure; dies aufgrund ihrer äusserst stabilen Struktur. Nun übertrug sich das infektiöse Prion von Schafen auf Rinder. Die Krankheit, welche durch PRPsc bei Rindern ausgelöst wird, nennen wir BSE (Bovine Sponpngorme Enzephalopathie). BSE verursacht Nervensystem- und Gehirnschäden. Krankheiten können allgemein drei Ursachenhaben, nämlich Bakterien, Viren oder Stoffwechsel. Es wurden aber bei BSE-Befallenen keine Bakterien oder Viren gefunden. Esmuss aber einen Organismus geben, der sich reproduziert und dem Körper Schaden zufügt. Vermutung: Proteine (angefeindete Hypothese, früher als ketzerisch angeschaut). Die Suche hat tatsächlich eine vierte Ursache, nämlich ein Protein, ergeben - PRPsc.
Aufnahme und Vervielfältigung
Da das PRPsc sehr stabile Strukturen aufweist, ist es "prothease resistant", wird also von den Protheasen im Magen nicht in die AS zerlegt. Somit überbesteht es den Verdauungstrakt unbeschadet. Proteine sind grosse Teilchen; damit ein Stoff wirklich aufgenommen wird, muss es auch durch die Membrane ins Blut. Trick: Das infektiöse Prion ist einem Protein ähnlich, das aktiv aufgenommen wird.
Dass die Reise bis ins Gehirn führt, ist sehr unwahrscheinlich, da das grosse Teilchen, das Prion, durch Sicherheitsschranken gelangen muss, so z.B. die Blut-Gehirn-Schranke (bewahrt vor Schadstoffen aus dem Blut), welche toxikologische Relevanz besitzt. Der Weg durch den Körper sieht folgendermassen aus: (1) Verdauungstrakt (2) Resorption (vom Verdauungstrakt ins Blut) und (3)Wanderung ins Gehirn.
Wenn das grosse Protein diese Schranke überwindet, kann es zu einer Vermehrung kommen: Das falsche infektiöse Prion vom Rind kommt in Kontakt mit dem richtigen Prion des Menschen. Dabei wird das richtige ebenfalls falsch (die Kräfte werden durch denKontakt so, dass das richtige in die falsche 3D-Form fällt). Schema: richtig – falsch → falsch – falsch. Ein Prion, das „falsch wurde“, ist aber noch nicht weiter schlimm. Die Ansteckung/Vermehrung besteht darin, dass viele „richtige“ Proteine in „falsche“umgeformt werden.
PRPc (Mensch) → Kontakt mit PRPsc (Mensch) → wird auch zu PRPsc
Der Vermehrungsvorgang beschleunigt sich selbst und wird als Katalyse bezeichnet. Die kranken Prionen wirken dabei wie ein Katalysator. "Der Körper löscht sich sozusagen selbst aus."

Es kommt zu einer Verklebung von Proteinen bei der Denaturierung. Dies führt zu Ablagerungen im Gehirn. Andere Zellen werden am Wachsen gehindert. Sie sterben ab, weil der Abfall nicht entsorgt wird, es findet keine Versorgung statt. Transportvorgänge der Zellen gestört! „Löcher“ entstehen im Gehirn (schwammartig, "spongiform"). Das Verhalten wird verändert, Erinnerungen gehen verloren, etc. Ein Paradebeispiel dafür, dass eine kleine Änderung der Form massive Auswirkungen haben kann!
Bei Alzheimer werden ebenfalls Proteine verformt, genauso bei Multipler Sklerose. Es kommt auch dort zu Ablagerungen. Veränderte Form führt zur Denaturierung, welche wiederum zu Ablagerungen führt. Dies ist bei vielen Krankheiten so. Viren und Bakterien sind leicht zu bekämpfen, doch körpereigene Stoffe nur sehr mühsam.
Quellen
Medienspezifisch:
- Abb. 1: Erstellt von Merlin Schär
- Abb. 2: http://www.chem.wisc.edu/~newtrad/CurrRef/AIDStopic/AIDSfig/2_06b.gif
- Abb. 3: http://cropandsoil.oregonstate.edu/classes/css430/lecture%209-07/figure-09-03.JPG
- Abb. 4: Molecular Biology of the Cell by Garland Science, vereinfacht und übersetzt von Merlin Schär und Giuseppe Spinella
- Abb. 5: Molecular Biology of the Cell by Garland Science
- Abb. 6: http://www.filzlexikon.de/fillex/wolle/chemie/gif/brueckbind.gif, verändert und vereinfacht
- Abb. 7: http://fig.cox.miami.edu/~cmallery/150/protein/Hb-scan.jpg
- Abb. 8: Erstellt von Merlin Schär und Giuseppe Spinella
- Abb. 9: Elektronische Unterlagen zu Proteinen von Hr. Deuber, verändert von Merlin Schär
- Abb. 10: http://www.scheffel.og.bw.schule.de/faecher/science/biologie/proteine_enzyme/7prionen/prion4.gif
Allgemeine Informationen:
- Überwiegend Chemieunterlagen (c. Proteine; 28.6.06 bis 11.9.2006 Abteilung 05D)
Als zusätzliche Stütze haben uns gedient:
- Microsoft Encarta Enzyklopädie Professional 2005
- http://www.tgs-chemie.de/proteine.htm [5]
- http://www.chemgapedia.de/vsengine/topics/de/vlu/index.html[6]
- http://www.bioc.unizh.ch/nanowelt/[7]
- http://www.swisseduc.ch/chemie/[8]
- http://www.vetmed.uni-giessen.de/biochem/Folien/Folie3-4.png[9]
- http://instruct1.cit.cornell.edu/courses/biog105/pages/demos/105/unit1/media/folding-protein.jpg [10]
- http://n.ethz.ch/student/meierdan/download/Bio1B/Voet/proteinfunktion.doc[11]
- http://flexikon.doccheck.com/Peptidbindung[12]
Erstellt von Merlin Schär und Giuseppe Spinella im Juni 2007, revidiert im Sommer 2008,
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Molecular Modelling, Einführung in die Biochemie [13]
- Für die Klasse 05D die nützlichen Animationen auf dem BSCW [14]
- Seite des Biochemischen Institutes Zürich, mit 3D-Modellen von Proteinen und Informationen zu 3D-Modellierungs-Programmen [15]
- Chime PlugIn-Download für ältere Web-Animationen (Internet Explorer) [16]