Katalyse: Unterschied zwischen den Versionen
| Zeile 77: | Zeile 77: | ||
Somit regelt die Sonde das Mischverhältnis und verhindert eine zugrosse Schadstoffbildung. | Somit regelt die Sonde das Mischverhältnis und verhindert eine zugrosse Schadstoffbildung. | ||
| − | Das λ muss immer um das Verhältnis 1:1 sein (λ-Fenster), sonst | + | Das λ muss immer um das Verhältnis 1:1 sein (λ-Fenster), sonst bilden sich zuviele Schadstoffe und der Katalysator wird überfordert. |
Version vom 19. Januar 2013, 10:56 Uhr
Inhaltsverzeichnis
Was ist eine Katalyse?
Als Katalyse bezeichnet man die Beschleunigung einer Reaktion durch einen Katalysator. Katalysatoren sind Stoffe die sich zur Beschleunigung einer Reaktion einsetzen lassen, wobei sie selbst nicht verbraucht werden.
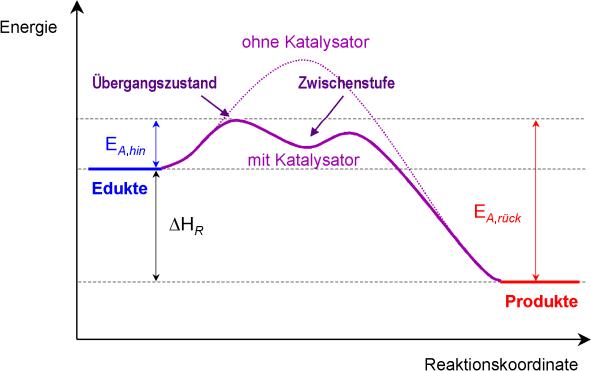
Energiediagramm:
Übergangszustand: Bindung an den Katalysator
Zwischenstufe: Lösen vom Katalysator und Bindung mit dem eigentlichen Teilchen
Schlussfolgerung: Mit einem Katalysator braucht man wesentlich weniger Aktivierungsenergie.
Wie funktioniert ein Katalysator?
Der Katalysator geht mit einem der Edukte eine Zwischenbindung ein. Er schwächt die zwischenmolekularen Kräfte des Eduktes und so kann das geschwächte Edukt mit weniger Energie mit dem anderen Edukt reagieren. Am Schluss hat man das Produkt und den wieder freigewordene Katalysator.
Ohne Katalysator: A + B => AB braucht viel Energie
Mit Katalysator: A + K(atalysator) => AK und AK + B => AB + K weniger Energie
Die einzelnen Teilschritte (Reaktion mit einem Katalysator) brauchen weniger Energie und somit hat eine grössere Anzahl Teilchen die erforderliche Mindestenergie zur Reaktion. Beide Teilreaktionen verlaufen schneller, somit auch die Gesamtreaktion.
Heterogene / Homogene Katalyse
Es gibt zwei verschiedene Arten von Katalyse, die heterogene und die homogene Katalyse.
Bei der heterogenen Katalyse unterscheidet sich der Aggregatszustand des Katalysators vom Aggregatszustand der reagierenden Stoffe. Der Katalysator ist hierbei meist ein Feststoff. Dies erleichtert das Abtrennen des Katalysators vom Reaktionsgemisch nach der Reaktion. Zu diesen Katalysatoren gehört der Autokatalysator.
Bei der homogenen Katalyse befinden sich der Katalysator wie auch der reagierende Stoff im gleichen Aggregatszustand. Das hat den Vorteil, dass es mildere Reaktionsbedingungen benötigt (z.B. niedriger Druck). Jedoch ist die Trennung des Katalysators vom Reaktionsgemisch erschwert. Zu diesen Katalysatoren gehören Enzyme.
Beispiele zur Katalyse
Anzünden von Zucker
Versucht man den Zucker mit einem Streichholz anzuzünden, schmilzt er. Wenn wir ihn nun aber mit Asche überziehen und dann anzünden, brennt er. Die Asche wirkt hier als Katalysator.
Enzyme
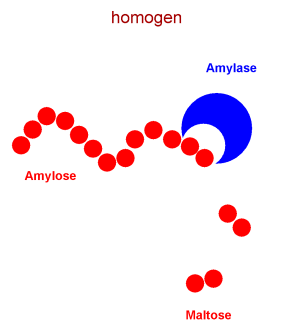
Wie schon oben erwähnt, gehören die Enzyme zur homogenen Katalyse. Die Amylase ist zum Beispiel ein typischer Katalysator. Sie spaltet lange Glucose-Ketten (Amylose) der Stärke in Disaccharid Maltose.
Autoabgaskatalysator
Wenn es bei der Verbrennung von Benzin (C8H18) zu wenig oder zuviel Sauerstoff (O2) hat, entstehen Schadstoffe. Zu den Schadstoffen gehören: CO, HC, NOx, Feststoffe.
Zuviel Sauerstoff: O2 + N2 -> 2NO
Zuwenig Sauerstoff: Bildung von CO und kurzeitige CxHy - Verbindungen
Damit Schadstoff nicht die Luft verschmutzt, wandelt sie ein Katalysator um. Es gibt zwei Stufen des Katalysators. Eine wandelt die Schadstoffe mit Hilfe von Sauerstoff um, die andere ohne.
ohne Sauerstoff: 2NO + CO -> N2 + 2CO2
Mit Sauerstoff: 2CO + O2 -> 2CO2,
CxHy + z O2 -> aCO2 + bH2O
Da jedoch der Katalysator mit der produzierten Menge an Schadstoffe überfordert ist, braucht es noch die Lambda-Sonde.
Diese Misst den Ist-Gehalt von Sauerstoff und vergleicht ihn mit dem Soll-Gehalt (wieviel der Motor zu diesem Zeitpunkt braucht).
O2(Ist) / O2(Soll) =λ
Somit regelt die Sonde das Mischverhältnis und verhindert eine zugrosse Schadstoffbildung. Das λ muss immer um das Verhältnis 1:1 sein (λ-Fenster), sonst bilden sich zuviele Schadstoffe und der Katalysator wird überfordert.
Quellen
- http://www.google.ch/imgres?q=katalyse&num=10&hl=de&tbo=d&tbm=isch&tbnid=COYzTx3PbClLTM:&imgrefurl=http://www.chemgapedia.de/vsengine/vlu/vsc/de/ch/4/cm/kinetik/einf_kat.vlu/Page/vsc/de/ch/4/cm/kinetik/katalyse2.vscml.html&docid=9o-8DUxLW8lcAM&imgurl=http://www.chemgapedia.de/vsengine/media/vsc/de/ch/4/cm/kinetik/bilder/profil2.gif&w=591&h=371&ei=Hkn5UJvpOsXTsgaOoYG4AQ&zoom=1&iact=rc&dur=1&sig=108609485422497529777&page=1&tbnh=139&tbnw=221&start=0&ndsp=20&ved=1t:429,r:3,s:0,i:105&tx=81&ty=37&biw=1366&bih=673
- http://www.pci.tu-bs.de/aggericke/PC5-Grenzf/Heterogene%20Katalyse.pdf