Katalyse: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: „ == Was ist eine Katalyse? == Als Katalyse bezeichnet man die Beschleunigung einer Reaktion durch einen Katalysator. Katalysatoren sind Stoffe die sich lassen…“) |
|||
| Zeile 3: | Zeile 3: | ||
Als Katalyse bezeichnet man die Beschleunigung einer Reaktion durch einen Katalysator. | Als Katalyse bezeichnet man die Beschleunigung einer Reaktion durch einen Katalysator. | ||
| − | Katalysatoren sind Stoffe die sich | + | Katalysatoren sind Stoffe die sich zur Beschleunigung einer Reaktion einsetzen lassen, wobei sie selbst nicht verbraucht werden. |
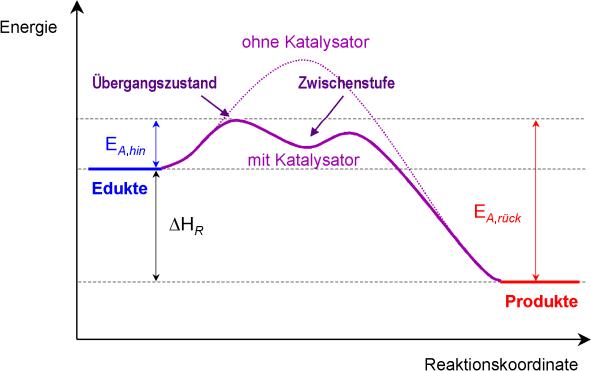
== Energiediagramm: == | == Energiediagramm: == | ||
| + | [[Datei:1.JPEG]] | ||
Übergangszustand: Bindung an den Katalysator | Übergangszustand: Bindung an den Katalysator | ||
| + | |||
Zwischenstufe: Lösen vom Katalysator und Bindung mit dem eigentlichen Teilchen | Zwischenstufe: Lösen vom Katalysator und Bindung mit dem eigentlichen Teilchen | ||
| + | |||
Schlussfolgerung: Mit einem Katalysator braucht man wesentlich weniger Aktivierungsenergie. | Schlussfolgerung: Mit einem Katalysator braucht man wesentlich weniger Aktivierungsenergie. | ||
| Zeile 20: | Zeile 23: | ||
Ohne Katalysator: A + B => AB braucht viel Energie | Ohne Katalysator: A + B => AB braucht viel Energie | ||
| − | Mit Katalysator: A + K(atalysator) => AK und AK + B => AB + K weniger Energie | + | Mit Katalysator: A + K(atalysator) => AK und AK + B => AB + K weniger Energie |
| − | Die einzelnen Teilschritte | + | Die einzelnen Teilschritte (Reaktion mit einem Katalysator) brauchen weniger Energie und somit hat eine grössere Anzahl Teilchen die erforderliche Mindestenergie zur Reaktion. Beide Teilreaktionen verlaufen schneller, somit auch die Gesamtreaktion. |
Version vom 4. Januar 2013, 09:54 Uhr
Was ist eine Katalyse?
Als Katalyse bezeichnet man die Beschleunigung einer Reaktion durch einen Katalysator. Katalysatoren sind Stoffe die sich zur Beschleunigung einer Reaktion einsetzen lassen, wobei sie selbst nicht verbraucht werden.
Energiediagramm:
Übergangszustand: Bindung an den Katalysator
Zwischenstufe: Lösen vom Katalysator und Bindung mit dem eigentlichen Teilchen
Schlussfolgerung: Mit einem Katalysator braucht man wesentlich weniger Aktivierungsenergie.
Wie funktioniert ein Katalysator?
Der Katalysator geht mit einem der Edukte eine Zwischenbindung ein. Er schwächt die zwischenmolekularen Kräfte des Eduktes und so kann das geschwächte Edukt mit weniger Energie mit dem anderen Edukt reagieren. Am Schluss hat man das Produkt und den wieder freigewordene Katalysator.
Ohne Katalysator: A + B => AB braucht viel Energie
Mit Katalysator: A + K(atalysator) => AK und AK + B => AB + K weniger Energie
Die einzelnen Teilschritte (Reaktion mit einem Katalysator) brauchen weniger Energie und somit hat eine grössere Anzahl Teilchen die erforderliche Mindestenergie zur Reaktion. Beide Teilreaktionen verlaufen schneller, somit auch die Gesamtreaktion.