Chemisches Rechnen: Unterschied zwischen den Versionen
(→Reaktionsgleichung) |
K (1 Version) |
(kein Unterschied)
| |
Version vom 7. Oktober 2008, 17:22 Uhr
Um eine Reaktion durchführen zu können, muss man wissen, welche Mengen der einzelnen Stoffe braucht. Dazu berechnet man die Verhältnisse, in denen die Stoffe zueinander stehen. Man nennt dieses chemische Rechnen auch Stöchiometrie.
Inhaltsverzeichnis
Reaktionsgleichung
Bei der Reaktionsgleichung sieht man, welche Stoffe man für eine Reaktion benötigt und welche entstehen. Im folgenden Beispiel feuern wir eine Miniaturkanone ab. Als Brennstoff nehmen wir Pentan (C5H12). Dieser reagiert mit Sauerstoff, wobei Kohlendioxid und Wasser entsteht. Die Gleichung lautet also wie folgt:
C5H12 + O2 → CO2 + H2O
Somit haben wir zwar alle Stoffe, doch auf der linken Seite (Edukte) haben wir viel mehr Wasserstoff, dafür auf der rechten Seite (Produkte) mehr Sauerstoff. Da die Elemente nicht aus dem Nichts heraus entstehen können, müssen wir die Gleichung entsprechend anpassen, sodass auf beiden Seiten von jedem Element die gleiche Anzahl Atome vorhanden ist (In unserem Beispiel auf beiden Seiten gleich viele C-Atome, H-Atome und O Atome). Die Stoffe selber dürfen dabei nicht verändert werden, es werden nur Zahlen vor die Stoffe gesetzt. Aus CO2 darf man beispielsweise nicht C2O4 machen, aber man darf 2 CO2 machen. Das bedeutet dann, dass 2 x 1 C-Atom und 2 x 2 O-Atome vorhanden sind. Man nennt das "Ausgleichen der Reaktionsgleichung". Es gibt hierfür keine rezeptartige Vorgehensweise, man muss einfach solange probieren, bis die Gleichung stimmt. Durch gute mathematische Überlegungen kann man das Ganze natürlich recht schnell lösen. Die neue Gleichung lautet also:
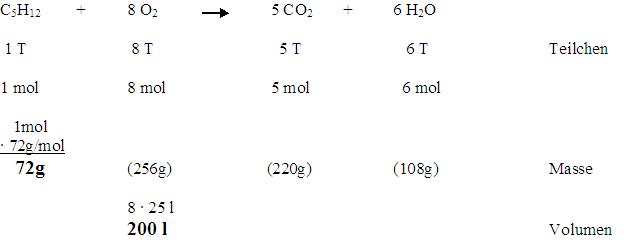
C5H12 + 8 O2 → 5 CO2 + 6 H2O
Bestimmen der Mengenverhältnisse
Im nächsten Schritt werden die Mengenverhältnisse der Stoffe bestimmt. Diese Mengenverhältnisse sind nicht die selben wie in der Reaktionsgleichung, da die Stoffe unterschiedlich schwer sind. Dafür berechnen wir jetzt ausgehend von der Reaktionsgleichung die Molmasse. Da es bei Gasen allerdings keinen Sinn macht, die Masse anzuschauen, berechnen wir für diese das Molvolumen.
Wir haben nur die Werte der Edukte berechnet, da wir ja wissen wollen, wieviel Pentan wir für die Reaktion bebötigen.
Berechnen der Werte
Nun haben wir zwar die Verhältnisse, wir können diese Mengenangaben nur benutzen, wenn unsere Minikanone 200 Liter Sauerstoff fassen würde, was natürlich unsinnig ist. Zunächst müssen wir berechnen, wie gross das Volumen unserer Kanone ist. Dazu nehmen wir an, dass das Kanonenrohr zylinderförmig ist, eine Höhe von 15 Zentimetern und einen Radius von 0,8 Zentimetern hat. Jetzt können wir mit der Formel Grundfläche mal Höhe das Volumen des Rohres berechnen:
V = r2 · π · h = 0,82 · π · 15 = 30,14cm3
Da 1 Kubikzentimeter 0,01 Liter entspricht, müssen wir das Resultat noch entsprechend anpassen:
30,14cm3 = 30,14 · 10-2l
Jetzt wissen wir also, wie viel Sauerstoff in der Kanone enthalten ist. Wir müssen nur noch berechnen, wie viel Pentan wir hinzugeben müssen. Mithilfe der Mengenverhältnisse gibt es einen einfachen Dreisatz:
200 Liter O2 entsprechen 72 Gramm C5H12
30,14 · 10-2 Liter O2 entsprechen x Gramm C5H12
30,14 · 10-2 l / 200 l · 72 g = 0,0108g
Damit sind wir mit unseren Berechnungen fertig. Wir müssen 0,0108 Gramm Pentan hinzufügen, den Zündungsmechanismus betätigen, und wir haben das gewünschte Resultat: die Kanone feuert.
Analog zu diesem Beispiel kann man auch bei anderen Reaktionen die Mengen berechnen. Man muss dabei allerdings immer alle Vorraussetzungen genau beachten.
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie