Das Prinzip des Energieminimums: Unterschied zwischen den Versionen
K |
K (→Grundsätzliches) |
||
| Zeile 2: | Zeile 2: | ||
== Grundsätzliches == | == Grundsätzliches == | ||
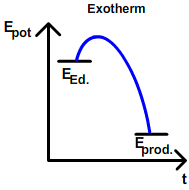
| − | Beobachtung: [[Die Reaktionsenthalpie ΔH| | + | Beobachtung: Alle [[Die Reaktionsenthalpie ΔH|exothermen]] Reaktionen laufen unter Energieabgabe (in Form von Wärme, Licht) freiwillig ([[Spontane und unspontane Reaktionen|spontan]]) ab. |
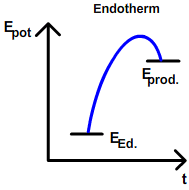
| − | Aufgrund dieser Beobachtung kommt man zu der Annahme, dass alle Stoffe nach ihrem energieärmsten Zustand streben, also mit anderen Stoffen unter Energieabgabe reagieren | + | Aufgrund dieser Beobachtung kommt man zu der Annahme, dass '''alle Stoffe nach ihrem energieärmsten Zustand streben''', also mit anderen Stoffen unter Energieabgabe reagieren wollen. Grundsätzlich ist diese '''Annahme richtig. Doch:''' Es gibt auch [[Die Reaktionsenthalpie ΔH|endotherme] Reaktionen, die freiwillig geschehen. Beispiele dafür sind das Lösen von Salzen in Wasser oder auch das Verdunsten von Wasser. Würde es nur [[Die Reaktionsenthalpie ΔH|exotherme]] Reaktionen geben, würden die Gesamtheit an Stoffen unter Abgabe von ihrer jeweiligen Kondensations- bzw. Erstarrungswärme zu Festkörpern werden. Es gäbe kein Gas, keine Flüssigkeiten. Da dies klar ein Trugschluss ist, muss noch eine zweite Kraft existieren, die das Gegenteil bewirkt: [[Die Entropie ΔS]] |
[[Bild:Exotherm_(Autor_Marko_Zivkovic).gif]][[Bild:Endotherm_(Autor_Marko_Zivkovic).gif]] | [[Bild:Exotherm_(Autor_Marko_Zivkovic).gif]][[Bild:Endotherm_(Autor_Marko_Zivkovic).gif]] | ||
| − | |||
== Quellen == | == Quellen == | ||
Version vom 22. Juni 2010, 22:23 Uhr
Definition: Die Tendenz zum Erreichen des energieärmsten Zustandes
Grundsätzliches
Beobachtung: Alle exothermen Reaktionen laufen unter Energieabgabe (in Form von Wärme, Licht) freiwillig (spontan) ab. Aufgrund dieser Beobachtung kommt man zu der Annahme, dass alle Stoffe nach ihrem energieärmsten Zustand streben, also mit anderen Stoffen unter Energieabgabe reagieren wollen. Grundsätzlich ist diese Annahme richtig. Doch: Es gibt auch [[Die Reaktionsenthalpie ΔH|endotherme] Reaktionen, die freiwillig geschehen. Beispiele dafür sind das Lösen von Salzen in Wasser oder auch das Verdunsten von Wasser. Würde es nur exotherme Reaktionen geben, würden die Gesamtheit an Stoffen unter Abgabe von ihrer jeweiligen Kondensations- bzw. Erstarrungswärme zu Festkörpern werden. Es gäbe kein Gas, keine Flüssigkeiten. Da dies klar ein Trugschluss ist, muss noch eine zweite Kraft existieren, die das Gegenteil bewirkt: Die Entropie ΔS
Quellen
- Chemieunterlagen
- Chemiebuch "Elemente"
Weblinks
- Swisseduc – Unterrichtsserver für Chemie