Das Prinzip des Energieminimums: Unterschied zwischen den Versionen
K (1 Version) |
|||
| Zeile 1: | Zeile 1: | ||
| − | == | + | ''Definition:'' Die Tendenz zum Erreichen des energieärmsten Zustandes eines Stoffes |
| − | + | ||
| + | == Grundsätzliches == | ||
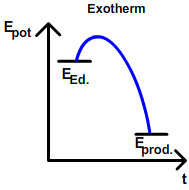
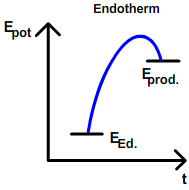
| + | Beobachtung: [[Die Reaktionsenthalpie ΔH|Exotherme]] Reaktionen laufen unter Energieabgabe (in Form von Wärme, Licht) freiwillig ([[Spontane und unspontane Reaktionen|spontan]]) ab. | ||
| + | Aufgrund dieser Beobachtung kommt man zu der Annahme, dass alle Stoffe nach ihrem energieärmsten Zustand streben, also mit anderen Stoffen unter Energieabgabe reagieren zu wollen. Grundsätzlich ist diese Annahme richtig. Doch: Es gibt auch [[Die Reaktionsenthalpie ΔH|endotherme] Reaktionen, die freiwillig geschehen. Beispiele dafür sind das Lösen von Salzen in Wasser, oder auch das Verdunsten von Wasser. Würden nur exotherme Reaktionen bestehen, würden alle Stoffe unter Abgabe von ihrer jeweiligen Kondensations- bzw. Erstarrungswärme Festkörper werden. Da dies ein Trugschluss ist, muss noch eine zweite Kraft existieren, die das Gegenteil bewirkt: [[Die Entropie ΔS]] | ||
| − | + | ||
[[Bild:Exotherm_(Autor_Marko_Zivkovic).gif|right]][[Bild:Endotherm_(Autor_Marko_Zivkovic).gif|right]] | [[Bild:Exotherm_(Autor_Marko_Zivkovic).gif|right]][[Bild:Endotherm_(Autor_Marko_Zivkovic).gif|right]] | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Quellen == | == Quellen == | ||
* Chemieunterlagen | * Chemieunterlagen | ||
| + | * Chemiebuch "Elemente" | ||
== Weblinks == | == Weblinks == | ||
Version vom 22. Juni 2010, 22:19 Uhr
Definition: Die Tendenz zum Erreichen des energieärmsten Zustandes eines Stoffes
Grundsätzliches
Beobachtung: Exotherme Reaktionen laufen unter Energieabgabe (in Form von Wärme, Licht) freiwillig (spontan) ab. Aufgrund dieser Beobachtung kommt man zu der Annahme, dass alle Stoffe nach ihrem energieärmsten Zustand streben, also mit anderen Stoffen unter Energieabgabe reagieren zu wollen. Grundsätzlich ist diese Annahme richtig. Doch: Es gibt auch [[Die Reaktionsenthalpie ΔH|endotherme] Reaktionen, die freiwillig geschehen. Beispiele dafür sind das Lösen von Salzen in Wasser, oder auch das Verdunsten von Wasser. Würden nur exotherme Reaktionen bestehen, würden alle Stoffe unter Abgabe von ihrer jeweiligen Kondensations- bzw. Erstarrungswärme Festkörper werden. Da dies ein Trugschluss ist, muss noch eine zweite Kraft existieren, die das Gegenteil bewirkt: Die Entropie ΔS
Quellen
- Chemieunterlagen
- Chemiebuch "Elemente"
Weblinks
- Swisseduc – Unterrichtsserver für Chemie