Spontane und unspontane Reaktionen: Unterschied zwischen den Versionen
K (→Grundlegendes) |
(→Spontan oder unspontan?) |
||
| Zeile 31: | Zeile 31: | ||
* Ergibt sich einen Wert für '''ΔG°<0''', verläuft die Reaktion '''spontan''' (exergonisch) in einem abgeschlossenen System (kein Energieaustausch mit der Umgebung ist möglich, beispielsweise Gefäss im Vakuum). | * Ergibt sich einen Wert für '''ΔG°<0''', verläuft die Reaktion '''spontan''' (exergonisch) in einem abgeschlossenen System (kein Energieaustausch mit der Umgebung ist möglich, beispielsweise Gefäss im Vakuum). | ||
* Ergibt sich einen Wert für '''ΔG°>0''', verläuft die Reaktion '''unspontan''' (endergonisch) in einem abgeschlossenen System. | * Ergibt sich einen Wert für '''ΔG°>0''', verläuft die Reaktion '''unspontan''' (endergonisch) in einem abgeschlossenen System. | ||
| + | |||
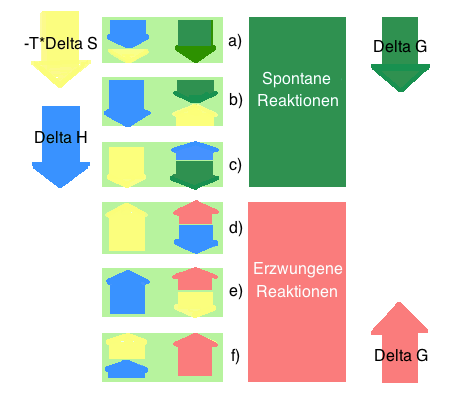
| + | Grundsätzlich gibt es je drei Möglichkeiten, wie eine Reaktion spontan/unspontan sein kann: | ||
| + | a) ∆H < 0 also günstig*, ∆S > 0 also ebenfalls günstig, somit ist ∆G < 0, '''spontan''' | ||
| + | b) ∆H < 0 also günstig, ∆S < 0 also ungünstig**, hier muss der Enthalpiefaktor ∆H überwiegen, somit ist ∆G < 0, '''spontan''' | ||
| + | c) ∆S > 0 also günstig, ∆H > 0 also ungünstig, hier muss der Entropiefaktor ∆S überwiegen, dann ist ∆G < 0, '''spontan''' | ||
| + | d) ∆S > 0 also ungünstig, ∆H < 0 also günstig, hier muss der Entropiefaktor ∆S überwiegen, dann ist ∆G > 0, '''unspontan''' | ||
| + | e) ∆H > 0 also ungünstig, ∆S > 0 also günstig, hier muss der Enthalpiefaktor ∆H überwiegen, somit ist ∆G < 0, '''unspontan''' | ||
| + | f) ∆H > 0 also ungünstig, ∆S < 0 also ungünstig, somit ist ∆G > 0, '''unspontan''' | ||
| + | |||
| + | Bemerkung: Die Temperatur T kann den Entropiefaktor ∆S verstärken, abhängig davon ob er günstig oder ungünstig ist! | ||
| + | *günstig : begünstigt einen spontanen Reaktionsablauf | ||
| + | **ungünstig : beungünstigt einen spontanen Reaktionsablauf | ||
| + | [[Bild:Spontan_unspontan.png|Spontane unspontane Reaktionen, energetische Situation]] | ||
==Beispielaufgaben== | ==Beispielaufgaben== | ||
Version vom 22. Juni 2010, 20:09 Uhr
Definition: Läuft eine Reaktion bei Standardbedingungen (Raumtemperatur, normaler Luftdruck) freiwillig ab, spricht man von einer spontanen Reaktion, das Mass für die Spontaneität ist die freie Enthalpie ΔG unter Einfluss der Enthalpie ΔH, der Entropie ΔS und der Temperatur.
Inhaltsverzeichnis
Grundlegendes
Es kann zwischen drei Arten von Reaktionsabläufen unterschieden werden, dabei muss in jedem Fall beachtet werden, dass die Zeit keinen Einfluss auf die Spontaneität hat.
- Spontane Reaktionen, rasch ablaufend
Beispiele: - Verbrennen von weissem Phosphor: Unter Standardbedingungen (Raumtemperatur, 1013 hPa Druck) läuft diese Reaktion spontan und sehr schnell ab, sobald weisser Phosphor in Berührung mit dem Luftbestandteil Sauerstoff kommt. Das ist der Grund, wieso weisser Phosphor im Chemielabor unter Wasser aufbewahrt werden muss. - Lösen einer Vielzahl von Salzen in Wasser Diese Reaktionen laufen selbständig und vollständig ab, alle Produkte reagieren miteinander zu Edukten.
- Spontane Reaktionen, langsam ablaufend
Beispiel: - Oxidieren von Papier: Bei Raumtemperatur vergilbt Papier, es reagiert mit dem Luftbestandteil Sauerstoff. Diese Reaktion kann durch das Aufbringen einer Aktivierungsenergie (in diesem Fall: heisse Flamme) extrem beschleunigt werden. Merke: Die Geschwindigkeit, mit der eine Reaktion abläuft, kann durch das Ändern der Reaktionsbedingungen beeinflusst werden.
- Unspontane Reaktionen
Dies sind Reaktionen, die ohne äusseren Zwang nicht ablaufen. Beispiel: - Bildung von Erdöl: Wäre die Bildung von Erdöl eine spontane Reaktion, wären wohl all unsere Energieprobleme gelöst. Will man Erdöl synthetisieren, muss Energie beispielsweise in Form von Druck oder einer gewissen Temperatur in die Reaktion eingebracht werden.
Spontan oder unspontan?
Um festzustellen, ob eine Reaktion spontan ist oder nicht, muss das Mass für die Spontaneität, die freie Enthalpie ΔG betrachtet werden. Es gilt: ΔG = ΔH - ΔS * T, T=absolute Temperatur in K bzw. für Standardbedingungen: ΔG° = ΔH° - ΔS° * 298
- Schritt 1: Abschätzen der Reaktionsenthalpie
- Schritt 2: Abschätzen der Entropie ΔS, Eruierung der Temperatur falls diese von 298 K abweicht
- Schritt 3: Einsetzen der errechneten Werte in die Gleichung ΔG = ΔH - ΔS * T
- Ergibt sich einen Wert für ΔG°<0, verläuft die Reaktion spontan (exergonisch) in einem abgeschlossenen System (kein Energieaustausch mit der Umgebung ist möglich, beispielsweise Gefäss im Vakuum).
- Ergibt sich einen Wert für ΔG°>0, verläuft die Reaktion unspontan (endergonisch) in einem abgeschlossenen System.
Grundsätzlich gibt es je drei Möglichkeiten, wie eine Reaktion spontan/unspontan sein kann: a) ∆H < 0 also günstig*, ∆S > 0 also ebenfalls günstig, somit ist ∆G < 0, spontan b) ∆H < 0 also günstig, ∆S < 0 also ungünstig**, hier muss der Enthalpiefaktor ∆H überwiegen, somit ist ∆G < 0, spontan c) ∆S > 0 also günstig, ∆H > 0 also ungünstig, hier muss der Entropiefaktor ∆S überwiegen, dann ist ∆G < 0, spontan d) ∆S > 0 also ungünstig, ∆H < 0 also günstig, hier muss der Entropiefaktor ∆S überwiegen, dann ist ∆G > 0, unspontan e) ∆H > 0 also ungünstig, ∆S > 0 also günstig, hier muss der Enthalpiefaktor ∆H überwiegen, somit ist ∆G < 0, unspontan f) ∆H > 0 also ungünstig, ∆S < 0 also ungünstig, somit ist ∆G > 0, unspontan
Bemerkung: Die Temperatur T kann den Entropiefaktor ∆S verstärken, abhängig davon ob er günstig oder ungünstig ist!
- günstig : begünstigt einen spontanen Reaktionsablauf
- ungünstig : beungünstigt einen spontanen Reaktionsablauf
Beispielaufgaben
Hier: Vier Typen chemischer Reaktionen
Quellen
- Chemieunterlagen Buch "Elemente"
- Unterrichtsstoff Herr Deuber
Weblinks
- Swisseduc – Unterrichtsserver für Chemie