Struktur und Eigenschaften der Metalle: Unterschied zwischen den Versionen
Aus Chemiewiki
Zur Navigation springenZur Suche springen (→Eigenschaften) |
(→Eigenschaften) |
||
| Zeile 21: | Zeile 21: | ||
*Verformbarkeit | *Verformbarkeit | ||
**Durch das Metallgitter, das im Gegensatz zum Ionengitter nur aus den positiv geladenen Atomrümpfen besteht (die Elektronen befinden sich in den Zwischenräumen und können deshalb ausser Acht gelassen werden), ist es möglich Metalle plastisch zu verformen, ohne dass sie zerbrechen. Ionengitter zerbrechen, da bei einer Verbiegung gleiche Ladungen aufeinandertreffen. | **Durch das Metallgitter, das im Gegensatz zum Ionengitter nur aus den positiv geladenen Atomrümpfen besteht (die Elektronen befinden sich in den Zwischenräumen und können deshalb ausser Acht gelassen werden), ist es möglich Metalle plastisch zu verformen, ohne dass sie zerbrechen. Ionengitter zerbrechen, da bei einer Verbiegung gleiche Ladungen aufeinandertreffen. | ||
| − | [[Bild:Struktur_und_Eigenschaften_der_Metalle_-_Chemiewiki_Kanti-Baden_Page_2_Image_0001.jpg]] | + | [[Bild:Struktur_und_Eigenschaften_der_Metalle_-_Chemiewiki_Kanti-Baden_Page_2_Image_0001.jpg|thumb|right|Verformbarkeit des Metallgitters]] |
Version vom 30. Mai 2010, 23:18 Uhr
Inhaltsverzeichnis
Vorkommen
Metalle haben schwache Anziehungskräfte auf ihre Elektronen, und kommen deshalb in der Natur nicht in elementarer Form vor, sondern als Ionen. Eine Ausnahme hiervon bilden die Edelmetalle, die nicht oder nur sehr langsam reagieren. Metalle können aber aus Erzen hergestellt werden, indem man ihnen die Elektronen zurückgibt. Letztlich werden jedoch alle so hergestellten Metalle über kurz oder lang vom Luftsauerstoff wieder oxidiert.
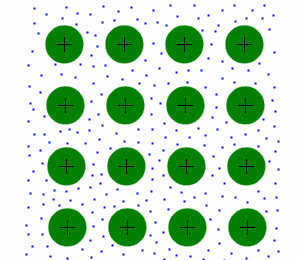
Struktur
Bei Metallen sind die Atomrümpfe (hier grün dargestellt) in einem Gitter angeordnet. Dieses Gitter ist sehr stabil, aber im Gegensatz zum Ionengitter auch verformbar. Die Elektronen (blau dargestellt) befinden sich frei beweglich (Stichwort Elektronengas) zwischen den Atomrümpfen.
Eigenschaften
- Elektrische Leitfähigkeit
- Voraussetzung: frei bewegliche geladene Teilchen. Dies trifft bei Metallen auf die Elektronen zu (siehe Abschnitt Struktur).
- Glanz
- Dadurch, dass die Elektronen frei beweglich sind, können sie alle energetischen Zustände annehmen. Sobald sie wieder in den geringeren Energiezustand zurückfallen, senden sie Licht aus. Deswegen können Metalle alle Farben des Spektrums reflektieren. Aus sehr glatten Metalloberflächen werden deshalb Spiegel hergestellt.
- Verformbarkeit
- Durch das Metallgitter, das im Gegensatz zum Ionengitter nur aus den positiv geladenen Atomrümpfen besteht (die Elektronen befinden sich in den Zwischenräumen und können deshalb ausser Acht gelassen werden), ist es möglich Metalle plastisch zu verformen, ohne dass sie zerbrechen. Ionengitter zerbrechen, da bei einer Verbiegung gleiche Ladungen aufeinandertreffen.
- Oxidation
- Durch die verhältnismässig schwachen Anziehungskräfte auf die Elektronen der Valenzschale, können diese sehr leicht von Nichtmetallen "gestohlen" werden. Das Metall wird dann zum Ion (siehe Abschnitt Vorkommen) und weist andere Eigenschaften auf als das Metall in atomarer Form.
- Thermische Leitfähigkeit
- Die einzelnen Metall-Atome befinden sich im Gitter sehr nahe beieinander. Deswegen werden Schwingungen schnell weitergegeben, was in einer sehr guten Wärmeleitfähigkeit resultiert.
- Dichte
- Durch das Elektronengas, welches zwischen den Atomrümpfen wie eine Art Kitt fungiert, ist das Metallgitter sehr dicht aufgebaut. Dementsprechend ist das spezifische Gewicht von Metallen relativ hoch.
Weblinks
Quellen
- Notizen aus dem Chemieunterricht
- Wikipedia: Metalle