Die Löslichkeit von Salzen: Unterschied zwischen den Versionen
(Die Seite wurde neu angelegt: Aufgrund ihrer starken Anziehungskräfte sind Salze grundsätzlich nur in hydrophilen Lösungsmitteln löslich. Für die Löslichkeit allgemein: Siehe Löslichkeit ...) |
|||
| Zeile 52: | Zeile 52: | ||
| − | [http:// | + | [http://media.putfile.com/Hydratisierung-eines-Salzes Vollständige Animation] |
Version vom 25. Oktober 2008, 12:54 Uhr
Aufgrund ihrer starken Anziehungskräfte sind Salze grundsätzlich nur in hydrophilen Lösungsmitteln löslich. Für die Löslichkeit allgemein: Siehe Löslichkeit
Inhaltsverzeichnis
Experiment
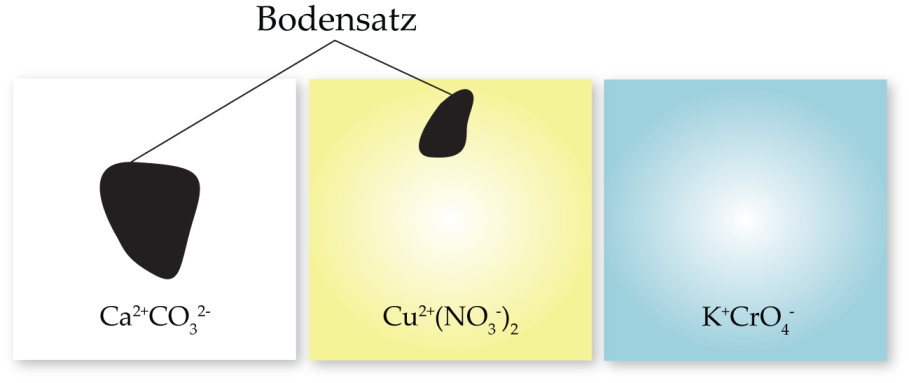
Drei Salze werden ins Wasser gegeben, sie haben alle verschiedene Löslichkeiten und lösen sich unterschiedlich gut.
Definition der Löslichkeit
Die maximale Menge eines Salzes das sich in einer bestimmten Menge Lösungsmittel löst. (100 ml)
Einheit: g/ml
Sobald die Löslichkeit eines Salzes erreicht ist, bildet sich ein Bodensatz, und die Lösung ist gesättigt.
Vorgang der Hydration
Ein Salz wird ins Wasser gegeben. Um nun den Vorgang des Auflösens zu begreifen, muss man bedenken dass das Ionengitter kein starrer, sondern ein kinetischer Zustand ist und die Ionen sich ständig bewegen. Sie "schubsen" sich ständig gegenseitig und werden auch von den Wassermolekülen angerempelt. Sobald sich nun ein Ion an der Oberfläche des Gitters ein bisschen weiter wegbewegt, gibt es 2 Möglichkeiten wie es weiter geht.
1. Das Prizip der Kräfte, Enthalpie
2. Das Prinzip der Wahrscheinlichkeit, Entropie
Beim Prinzip der Kräfte würde das Ion ins Ionengitter zurückkehren, da das Ionengitter eigentlich viel die stärkere Anziehungskraft als die umgebenden Wassermoleküle ausübt. Beim Prinzip der Wahrscheinlichkeit würde sich das Ion vom Gitter lösen und ein Wassermolekül übernähme die Rolle des Gegenions.
Da nun das Ion von vielen Wassermolekülen umgeben ist, aber nur von einem Ort im Gitter "zurückgezogen" wird, ist die Wahrscheinlichkeit grösser, dass sich das Ion vom Gitter trennt, und im Wasser verschwindet.
Analogie Menschenmenge
Wenn sich eine Gruppe in einer grossen Menschenmenge bewegt, und die Gruppe eigentlich zusammenbleiben möchte, passiert es doch sehr schnell, dass jemand verloren geht.
Schematische Darstellung
Screenshots der Animation:
Energetische Betrachtung
Um vorauszubestimmen ob eine Hydration exotherm oder endotherm ist, analysiert man den Prozess von der energetischen Seite.
Theoretisch betrachtet, gibt es zwei Faktoren die bestimmen ob der Vorgang endotherm oder exotherm ist.
1. Die Zerstörung des Ionengitters: Energieaufwand
2. Die Hydration der Ionen: Energieertrag
Wenn der Energieaufwand (die Zerstörung des Ionengitters) grösser ist als der Energieertrag (die Hydration der Ionen), dann ist die Reaktion endotherm.
Wenn der Energieaufwand (die Zerstörung des Ionengitters) kleiner ist als der Energieertrag (die Hydration der Ionen), dann ist die Reaktion exotherm.
Wenn man das Ganze jedoch experimentell nachprüft, dann ergibt sich folgende Schlussfolgerung:
Es gibt soviele Faktoren die die Hydration mitbestimmen dass man nicht zuverlässig voraussagen kann, wie exotherm oder wie endotherm eine Reaktion abläuft. Manchmal kann eine theoretisch exotherme Reaktion auch leicht endotherm sein.
Wann sind Salze also löslich?
Bei unlöslichen Salzen
-sind ist die Entropie (Wahrscheinlichtkeit) und die Enthalpie (Kräfte) ungünstig
-oder der ungünstige Faktor überwiegt
Bei Salzen die gut löslich
-sind entweder beide Faktoren günstig
-oder der günstige Faktor überwiegt
Kristallwasser
Unter Kristallwasser versteht man Wasser das ins Gitter eingebaut wird. Ein Beispiel um eine Anwendung zu veranschaulichen
Bsp: Geheimtinte
CO2+CL21- * 6H2O
Cobalt bildet mit 6 Wassermolekülen ein Komplexion:
[CO(6H2O)6]2+
Im Cobaltchlorid Hexahydrat ist jetzt dieses Komplexion und noch zwei Chlorionen enthalten.
Und zwar ist jedes Cobaltion von 8 Gegenionen umgeben, zwei davon Chlorionen und sechs Wassermoleküle.
Geheimtinte wird sichtbar, sobald man ein damit beschriebenes Blatt erhitzt.
| CO2+CL21- * 6H2O | → | CO2+CL21- + 6H2O |
| Cobaltchlorid Hexahydrat | Cobaltchlorid(Wasserfrei) |
Denn das Kristallwasser im Ionengitter verdampft, übrig bleibt Cobaltchlorid und wird sichtbar.
Erstellt von: Bianca Bolliger und Stefanie Eichler
Quellen
- Chemieunterlagen
- Animation von Herrn Deuber
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden
--Steffi bianca 01:53, 30 January 2008 (CST)[[Image:Media:Example.jpg]]