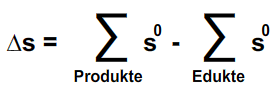Die Entropie ΔS: Unterschied zwischen den Versionen
Kim (Diskussion | Beiträge) (→Berechnung der Entropie ΔS) |
|||
| Zeile 1: | Zeile 1: | ||
| − | <i>Definition:</i> Die Entropie ΔS kann vereinfacht als | + | <i>Definition:</i> Die Entropie ΔS kann vereinfacht als Mass für die Unordnung eines Systems oder für ein Mass für die |
Wahrscheinlichkeit eines Zustands betrachtet werden. | Wahrscheinlichkeit eines Zustands betrachtet werden. | ||
== Grundlegendes == | == Grundlegendes == | ||
| − | === | + | === Wahrscheinlichkeit === |
| − | + | Die Entropie gibt Aufschluss darüber, ob die Anordnung der Edukte oder der Produkte wahrscheinlicher ist. Ist die Entropie gleich 0 ist die Wahrscheinlichkeit gleich gross. | |
| + | Ist die Entropie > 0 so steigt die Entropie und ist somit günstig. Ist die Entropie < 0 verhält es sich entrsprechen umgekehrt. | ||
| − | Die Entropie | + | Das heisst: <b>Die Natur strebt nach maximaler Entropie, d.h. maximaler Wahrscheinlichkeit. Das Streben nach maximaler Wahrscheinlichkeit kann nur durch starke Kräfte, d.h. das Streben nach minimaler Energie gebrochen werden (siehe unten).</b> |
| − | |||
| − | |||
| − | + | Die Entropie ist stark von der Wärme abhängig. Erhäht man die Temperatur, wird eine Reaktion bei günstiger Entropie noch günstiger, bei ungünstiger Entropie jedoch noch ungünstiger. | |
| − | |||
| − | Die Entropie ist stark von der Wärme abhängig. | ||
== Welche Reaktionen laufen spontan ab? == | == Welche Reaktionen laufen spontan ab? == | ||
| Zeile 20: | Zeile 17: | ||
=== Ausschlaggebend für Spontanität === | === Ausschlaggebend für Spontanität === | ||
| − | [[Bild:Entropie0.gif|thumb| Entropieveränderung von Wasser bei steigender Temperatur; je grösser die Temperatur, desto grösser die | + | [[Bild:Entropie0.gif|thumb| Entropieveränderung von Wasser bei steigender Temperatur; je grösser die Temperatur, desto grösser die Entropie] |
Ausschlaggebend für die Spontanität einer Reaktion ist die freie Enthalpie ΔG, die sich aus der Enthalpie ΔH und der Entropie ΔS | Ausschlaggebend für die Spontanität einer Reaktion ist die freie Enthalpie ΔG, die sich aus der Enthalpie ΔH und der Entropie ΔS | ||
zusammensetzt. Je negativer ΔH und je positiver ΔS,umso Spontaner die Reaktion. | zusammensetzt. Je negativer ΔH und je positiver ΔS,umso Spontaner die Reaktion. | ||
| − | <b>ΔS nimmt zu, wenn...</b> | + | <b>ΔS nimmt zu, wenn...</b> |
| + | |||
| + | * ...sich der Aggregatszustand in einen mit höherer Entropie ändert. | ||
| + | Hierbei gilt, dass Festkörper eine kleine, Flüssigkeite eine grössere und Gasen die grösste Entropie besitzen. | ||
| + | |||
| + | Vergleicht man die Anordung der Teilchen bei Feststofffen und bei Gasen, so bermekt man, dass sie bei Feststoffen sehr geordnet sind z.B. in einem Gitter. Die Wahrscheinlichkeit aber, dass sie genau so geordnet sind und nicht sonst irgendwo befinden, ist sehr klein. Bei Gasen sind die teilchen zufälliger angeordnet, somit gibt es mehr als eine mögiche Anordung und die Entropie ist grösser. | ||
| − | + | <b>ΔS nimmt zu, wenn...</b> | |
| − | + | * ...die Anzahl Teilchen zunimmt, wodurch die Wahrscheinlichkeit wieder steigt. (Ein grosses Molekül --> viele kleine Moleküle) | |
| − | + | Diese Tatsache ist so zu erklärren, dass z.B. zwei Teilchen sich an verschiedenen Ortan aufhalten, ist viel wahrscheinlich, als dass sie sich am gleichen Ort befinden und zusammen eine Bindung eingehen. | |
<b>ΔS nimmt zu, wenn...</b> | <b>ΔS nimmt zu, wenn...</b> | ||
| − | * ...Mischvorgänge stattfinden, | + | * ...Mischvorgänge stattfinden, da es ziemlich Unwahrscheinlich ist, dass sich die Teilchen unter einaner nicht vermischen. Da durch Vermischung eine grössere Anzahl von Anordnungen entstehen und damit die Wahrscheinlichkeit steigt. (Der Einfluss dieses Faktor ist am geringsten) |
** <i>Reinstoffe zu Gemischen reagieren:</i> | ** <i>Reinstoffe zu Gemischen reagieren:</i> | ||
*** Bsp: Würfelzucker ist ein Reinstoff, Wasser ist ein Reinstoff. Löst man den Zucker im Wasser auf, entsteht ein Gemisch. | *** Bsp: Würfelzucker ist ein Reinstoff, Wasser ist ein Reinstoff. Löst man den Zucker im Wasser auf, entsteht ein Gemisch. | ||
Version vom 29. Mai 2010, 12:06 Uhr
Definition: Die Entropie ΔS kann vereinfacht als Mass für die Unordnung eines Systems oder für ein Mass für die Wahrscheinlichkeit eines Zustands betrachtet werden.
Inhaltsverzeichnis
Grundlegendes
Wahrscheinlichkeit
Die Entropie gibt Aufschluss darüber, ob die Anordnung der Edukte oder der Produkte wahrscheinlicher ist. Ist die Entropie gleich 0 ist die Wahrscheinlichkeit gleich gross. Ist die Entropie > 0 so steigt die Entropie und ist somit günstig. Ist die Entropie < 0 verhält es sich entrsprechen umgekehrt.
Das heisst: Die Natur strebt nach maximaler Entropie, d.h. maximaler Wahrscheinlichkeit. Das Streben nach maximaler Wahrscheinlichkeit kann nur durch starke Kräfte, d.h. das Streben nach minimaler Energie gebrochen werden (siehe unten).
Die Entropie ist stark von der Wärme abhängig. Erhäht man die Temperatur, wird eine Reaktion bei günstiger Entropie noch günstiger, bei ungünstiger Entropie jedoch noch ungünstiger.
Welche Reaktionen laufen spontan ab?
Ausschlaggebend für Spontanität
[[Bild:Entropie0.gif|thumb| Entropieveränderung von Wasser bei steigender Temperatur; je grösser die Temperatur, desto grösser die Entropie]
Ausschlaggebend für die Spontanität einer Reaktion ist die freie Enthalpie ΔG, die sich aus der Enthalpie ΔH und der Entropie ΔS zusammensetzt. Je negativer ΔH und je positiver ΔS,umso Spontaner die Reaktion.
ΔS nimmt zu, wenn...
- ...sich der Aggregatszustand in einen mit höherer Entropie ändert.
Hierbei gilt, dass Festkörper eine kleine, Flüssigkeite eine grössere und Gasen die grösste Entropie besitzen.
Vergleicht man die Anordung der Teilchen bei Feststofffen und bei Gasen, so bermekt man, dass sie bei Feststoffen sehr geordnet sind z.B. in einem Gitter. Die Wahrscheinlichkeit aber, dass sie genau so geordnet sind und nicht sonst irgendwo befinden, ist sehr klein. Bei Gasen sind die teilchen zufälliger angeordnet, somit gibt es mehr als eine mögiche Anordung und die Entropie ist grösser.
ΔS nimmt zu, wenn...
- ...die Anzahl Teilchen zunimmt, wodurch die Wahrscheinlichkeit wieder steigt. (Ein grosses Molekül --> viele kleine Moleküle)
Diese Tatsache ist so zu erklärren, dass z.B. zwei Teilchen sich an verschiedenen Ortan aufhalten, ist viel wahrscheinlich, als dass sie sich am gleichen Ort befinden und zusammen eine Bindung eingehen.
ΔS nimmt zu, wenn...
- ...Mischvorgänge stattfinden, da es ziemlich Unwahrscheinlich ist, dass sich die Teilchen unter einaner nicht vermischen. Da durch Vermischung eine grössere Anzahl von Anordnungen entstehen und damit die Wahrscheinlichkeit steigt. (Der Einfluss dieses Faktor ist am geringsten)
- Reinstoffe zu Gemischen reagieren:
- Bsp: Würfelzucker ist ein Reinstoff, Wasser ist ein Reinstoff. Löst man den Zucker im Wasser auf, entsteht ein Gemisch.
- Elemente zu Verbindungen reagieren:
- Bsp: N2(g) + O2(g) --> 2NO(g)
- Reinstoffe zu Gemischen reagieren:
Berechnung der Entropie ΔS
"Die Summe der Entropien aller Produkte minus die Summe der Entropien aller Edukte ergibt die Änderung der Entropie"
Entscheidend für die Spontanität einer chemischen Reaktion ist also der Unterschied der Wahrscheinlichkeit. Ist der Zustand der Produkte Wahrscheinlicher als der Zustand der Edukte, kann die Reaktion spontan ablaufen.
Wichtig: Die Entropie ΔS ist die Beschreibung eines Zustandes, sie beschreibt die Wahrscheinlichkeit in einem System. Sie kann genau berechnet werden, aber um die Spontanität einer chemischen Reaktion zu analysieren genügt oft nur ein abschätzen. Mithilfe den oben genannten Kriterien kann man die Edukte und Produkte miteinander vergleichen und so bestimmen, ob ΔS > 0 oder < 0, und so spontan oder unspontan ist.
Quellen
- Chemieunterlagen von Herr Deuber