Experimentelle Hinweise: Unterschied zwischen den Versionen
| Zeile 13: | Zeile 13: | ||
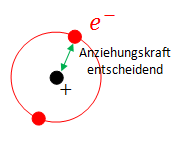
Die 1. Ionisierungsenergie hängt von der Anziehungskraft zwischen Atomkern und dem äussersten Elektron, welches man dem Atom entfernen will, ab. | Die 1. Ionisierungsenergie hängt von der Anziehungskraft zwischen Atomkern und dem äussersten Elektron, welches man dem Atom entfernen will, ab. | ||
| + | |||
[[Bild:Anziehungskraft entscheidend.png]] | [[Bild:Anziehungskraft entscheidend.png]] | ||
Version vom 20. März 2010, 15:34 Uhr
In diesem Abschnitt geht es darum, dass man durch die unterschiedlichen Ionisierungsenergien der Atome beweisen konnte, dass die Elektronenhülle schalenartig aufgebaut ist.
Inhaltsverzeichnis
Ionisierungsenergie
Die Ionisierungsenergie gibt an, wie viel Energie benötigt wird, um ein Elektron von einem Atom zu trennen. (Grafik entfernen positives Ion)
a) 1. Ionisierungsenergie gemäss Ordnungszahl
(Spalte im Periodensystem)
Die 1. Ionisierungsenergie hängt von der Anziehungskraft zwischen Atomkern und dem äussersten Elektron, welches man dem Atom entfernen will, ab.
Um die 1. Ionisierungsenergie gemäss Ordnungszahl zu veranschaulichen, betrachten wir die Ionisierungsenergien der ersten drei Atome im Periodensystem.
(Grafik Ionisierungsenergien)
In der Grafik sieht man, dass von Wasserstoff zu Helium die Ionisierungsenergie etwa um das doppelte zu nimmt. Das liegt daran, dass von Wasserstoff zu Helium ein Proton und ein Elektron hinzu kommen. Somit werden die Elektronen vom Kern etwa doppelt so stark angezogen und es wird etwa doppelt so viel Energie gebraucht um ein Elektron zu entfernen.
Von Helium zu Lithium nimmt die Ionisierungsenergie ab, obwohl wiederum ein Elektron und ein Proton hinzugekommen sind. Das heisst, es wird plötzlich weniger Energie gebraucht um das äusserste Elektron dem Atom zu entziehen.
Vom Coulomb Gesetz wissen wir, dass die Anziehungskraft proportional zum Abstand im quadrat ist. (Grafik Coulomb Gesetz)
Daher kann das nur so erklärt werden, dass das Elektron plötzlich viel weiter entfernt ist.
Schlussfolgerung: Das Elektron hat eine neue Schale angefangen. Die Elektronenhülle ist Quantisiert (Schalenförmig aufgebaut).
b) Ionisierungsenergien eines einzelnen Atoms (einer Zeile)
- Durch Entfernen eines Elektrons kommen die anderen Elektronen näher und die Anziehung zwischen den nähergekommenen Elektronen und dem Kern wird stärker. - Die Ladung der Elektronen und des Kerns bleibt aber gleich, obwohl sich die Ladung des ganzen Atoms natürlich schon verändert (wird positiv).
z.B. Bei Natrium, muss das zweite Elektron 10mal näher sein, da es viel stärker angezogen wird.
Noch 2 wichtige Hinweise: 1) Jedes weitere Element besitzt 1 Proton mehr! ->Kerne werden nicht müde! D.h. Der Kern zieht die Elektronen nicht stärker an, wenn weniger Elektronen vorhanden sind. Es spielt also keine Rolle, ob ein Atom drei oder 10 Elektronen anziehen muss. 2) Abstand muss konstant sein (ich weiss ned genau wien ich das söll erkläre… du scho?)
Schlussfolgerungen
Bei a) haben wir die Gesamtheit aller Atome betrachtet und gesehen, dass die Ionisierungsenergie angibt, wieviel Energie man braucht, um das äusserste Elektron eines Atoms zu "entfernen".
Bei b) haben wir uns ein einzelnes Atom angesehen und untersucht, was beim Entfernen passiert bzw. was die Folgen sind. Entfernt man ein Elektron, rücken die Anderen näher richtung Kern und die Ionisierungsenergie um weitere Elektronen zu entfernen wird grösser(da näher und somit stärker vom Kern angezogen). Daraus folgt: -> Die elektronen Hülle ist schalenartig aufgebaut!!
Quellen
Ionisierungsenergie http://de.wikipedia.org/wiki/Ionisierungsenergie
Notizen aus dem Unterricht
Grafik Ionisierungsenergien http://de.academic.ru/pictures/dewiki/73/IonizationEnergyAtomicWeight.PNG