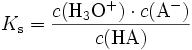Berechnen und Messen des pH-Werts: Unterschied zwischen den Versionen
Cyril (Diskussion | Beiträge) (Die Seite wurde neu angelegt: === pK<sub>S</sub>- und pK<sub>B</sub>-Wert === Der pK<sub>S</sub> gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewicht...) |
|||
| Zeile 8: | Zeile 8: | ||
Je tiefer der pK<sub>S</sub>-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pK<sub>B</sub>-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pK<sub>S</sub>+pK<sub>B</sub>=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. | Je tiefer der pK<sub>S</sub>-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pK<sub>B</sub>-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pK<sub>S</sub>+pK<sub>B</sub>=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. | ||
| + | __________________________ | ||
| + | |||
| + | |||
| + | |||
| + | == Das Messen von pH - Werten == | ||
| + | |||
| + | '''SIB - Indikatoren''' | ||
| + | |||
| + | Prinzip: H Ind. ⇌ Ind.<&sup-;>-</²> + H+ | ||
| + | Farbe 1 Farbe 2 | ||
Version vom 13. Juni 2011, 17:20 Uhr
pKS- und pKB-Wert
Der pKS gibt Auskunft darüber, wie stark eine Säure ist. Es ist der negative Logarithmus der Gleichgewichtskonstante KS, welche sich folgendermassen berechnet:
Der pKS-Wert ist somit die Stärke der Säure gegenüber Wasser. HA ist hierbei die Säure, welche ihr Proton abgibt. Die Konzentration des Wassers kann hier vernachlässigt werden, da sie beinahe konstant bleibt, weshalb wird sich noch beim Kapitel des pH-Wertes zeigen. Man sieht hier also, dass bei einem hohen KS-Wert die Konzentration an Edukten sehr niedrig ist.
Je tiefer der pKS-Wert (da wie pH-Wert der negative Logarithmus verwendet wird), desto stärker die Säure. Dasselbe gilt auch für den pKB-Wert, je tiefer dieser ist, desto stärker die Base. Bei einem konjugierten Säure-Base-Paar gilt: pKS+pKB=14. Hier sieht man auch wieder, dass eine starke Säure eine schwache konjugierte Base hat. __________________________
Das Messen von pH - Werten
SIB - Indikatoren
Prinzip: H Ind. ⇌ Ind.<&sup-;>-</²> + H+ Farbe 1 Farbe 2