Die Löslichkeit von Salzen: Unterschied zwischen den Versionen
Armax (Diskussion | Beiträge) (→B) Lösungsvorgang von Salzen) |
Armax (Diskussion | Beiträge) (→C) Experiment: Energetische Betrachtung) |
||
| Zeile 408: | Zeile 408: | ||
| − | [[Datei:Tabelle Salze1.png|700px|thumb|left|Messen der Temperatur beim Lösen einiger Salze (endotherm / exotherm)]] | + | [[Datei:Tabelle Salze1.png|700px|thumb|left|Abb. 8: Messen der Temperatur beim Lösen einiger Salze (endotherm / exotherm)]] |
Version vom 21. Juni 2024, 15:03 Uhr
Aufgrund der starken Anziehungskräfte von Ionen sind Salze grundsätzlich nur in hydrophilen Lösungsmitteln löslich. Für die Löslichkeit allgemein: Siehe Löslichkeit
Inhaltsverzeichnis
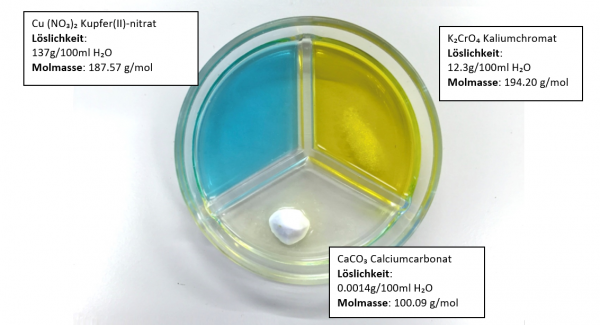
Exp.: Wie lösen sich verschiedene Salze in Wasser ?
Vorgehen:
Von den drei Salzen Cu(NO₃)₂, K₂CrO₄ und CaCO₃ wird je gleich viel (ein Löffel) in eine dreigeteilte Petrischale gegeben. Diese Petrischale ist mit Wasser gefüllt. Welches Salz löst sich wie gut?
Ergebnis:
Cu(NO₃)₂ : hat sich komplett aufgelöst.
K₂CrO₄ : hat sich teilweise aufgelöst.
CaCO₃ : hat sich fast nicht aufgelöst.
Bei diesem Experiment erkennt man sehr grosse Unterschiede in der Löslichkeit von Salzen.
Das heisst: Salze lösen sich verschieden gut in Wasser.
A) Löslichkeit: Ausgangslage
Salze sind unterschiedlich gut löslich. Wir benötigen ein Mass für die Löslichkeit !
Definition:
Bei der Löslichkeit handelt es sich um die Eigenschaft, welche beschreibt ob und in welchem Umfang sich ein Salz in einem Lösungsmittel maximal löst.
Wenn die maximale Menge eines Salzes in einer Lösung gelöst ist, spricht man von einer gesättigten Lösung. Überschüssiges Salz wird als Bodensatz sichtbar.
Falls über die Löslichkeitsgrenze hinaus ein weiteres Salz hinzugefügt wird, kann dieses sich nicht mehr lösen und bildet ebenfalls einen Bodensatz.
Einheit:
Gramm pro Liter (g/L) oder Mol pro Liter (mol/L).
Umrechnung: von g/L in mol/L:
1. Molare Masse:
Um die Umrechnung durchführen zu können, braucht man die molare Masse. Diese gibt an, wie viel Gramm ein Mol des Stoffes wiegt und hat die Einheit Gramm pro Mol (g/mol).Diese findet man im Periodensystem, in dem man die Atommasse der gelösten Stoffes addiert.
2. Dreisatz Rechnung:
Die Konzentration in mol/L ist gesucht. Gegeben ist die molare Masse in g/mol.
Um die Konzentration einer Lösung in Mol pro Liter aus der Masse der Substanz in Gramm pro Mol zu berechnen, gehen wir wie folgt vor:
Zuerst rechnen wir die Anzahl Mol aus mit einer gegebenen Masse:
Bsp.: Molmasse Kupfer(II)-nitrat ( Cu(NO₃)₂ ): 187.55g/mol
Über eine Dreisatz Rechnung kann man die Molanzahl der gewünschten Menge berechnen. Angenommen wir hätten 10 Gramm Kupfer(II)-nitrat gelöst.
187.55 g = 1 Mol
1 : 187.5 =
1 g = 0.00533191 Mol
0.00533191 Mol x 10
10 g = 0.0533191 Mol
Dieses Ergebnis muss man jetzt noch durch die Anzahl an Volumen teilen, also in diesem Beispiel wären es 1 Liter, da mol/L immer auf 1 Liter geht.
0.0533191/1 Mol = 0.0533191 mol/L
Dies ist nun die Konzentration von Kupfer(II)-nitrat in einem Liter Wasser.
Schlussfolgerung:
1. Warum lösen sich Salze überhaupt?
2. Welche Faktoren bestimmen die Löslichkeit?
B) Lösungsvorgang von Salzen
Grundlegendes:
1. Warum lösen sich Salze überhaupt?
Folgende drei Aspekte spielen bei der Lösung von Salzen in Wasser eine entscheidende Rollen:
- Die Wahrscheinlichkeit der Teilchenbewegung - Entropie ΔS
- Das Zusammenspiel der Gitterenergie, welche überwunden werden muss
- Die Hydrationsenergie, welche mithilft.
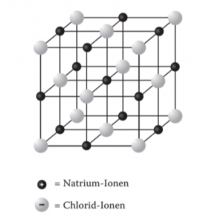
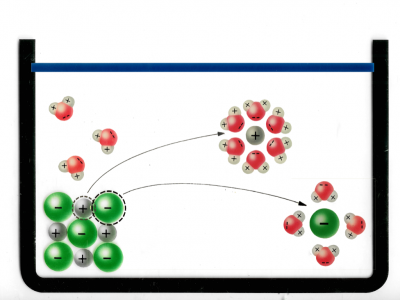
Beispiel: Lösen von NaCl (Kochsalz) in Wasser:
Hier sehen Sie eine Abbildung von einem NaCl Ionengitter:
Die schwarzen Punkte stellen die positiv geladenen Natrium-Kationen dar.
Die grauen Punkte stellen die negativ geladenen Chlorid-Anionen dar.
Kationen = Positiv geladenes Ion
Anionen = Negativ geladenes Ion
Zusammen bilden sie ein Ionengitter.
Wichtig zu wissen:
Das Ionengitter ist kein starrer, sondern ein kinetischer Zustand und die Ionen bewegen sich ständig. Sie "schubsen" sich ständig gegenseitig und werden auch von den Wassermolekülen angeregt.
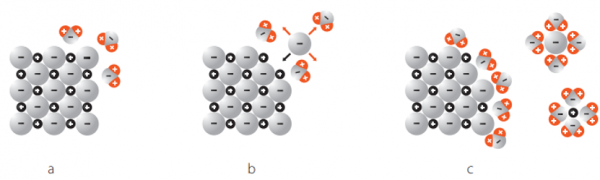
Nun geben wir das NaCl in Wasser:
a
Hier sieht man, wie sich die Wassermoleküle an das Ionengitter von NaCl haften. Das passiert, weil Wasser Polar geladen ist und Dipole hat, also Positiv und Negativ geladene Bereiche innerhalb des Moleküls.
Das heisst aber noch nicht, dass sich das Ionengitter nun löst.
b
Hier sieht man, wie sich ein Chlorid-Ion von dem Gitter löst. Das passiert durch die zufällige Teilchenbewegung und die Wahrscheinlichkeit: Entropie.
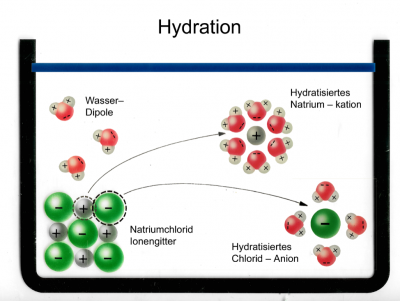
Dieser Vorgang heisst: Hydration
Von all den Bewegungsmöglichkeiten, welche das Chlorid-Ion hat, sind die meisten Möglichkeiten weg vom Gitter. Die Wahrscheinlichkeit, dass das Chlorid-Ion sich nachher wieder genau an die Ausgangsposition bewegt ist sehr unwahrscheinlich.
Entropie = "Es geschieht, was wahrscheinlich ist".
So wird die Gitterenergie überwunden. Nun sieht man, wie sich die positiven Sauerstoff (O) Pole des Wassers sich an die negativ geladenen Chlorid-Ionen kleben. Das passiert, weil sich negativ und positiv anzieht.
c
Hier sieht man, wie die positiven Wasserstoffatome der Wassermoleküle (H) die negativ geladenen Chlorid-Ionen anziehen und herauslösen.
Und darunter sieht man, wie sich die negativen Sauerstoffatome der Wassermoleküle (O), sich an die positiv geladenen Natrium-Ionen kleben.
Das passiert, weil sich negativ und positiv anzieht.
Detaillierter Ablauf vom Lösungsvorgang NaCl (Kochsalz) in Wasser:
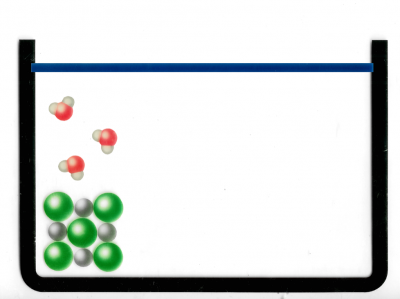
Abbildung 4: Hier sieht man, wie NaCl (Kochsalz) in einen Behälter gegeben wird. Genauer gesagt: Man sieht das Ionengitter eines NaCl-Moleküls auf Teilchenebene.
Abbildung 5: Hier sieht man, wie Wasser in das Gefäss gefüllt wurde. Die Rot-Grauen Moleküle sind Wassermoleküle (H₂O). Die grauen Kreise stehen für die H-Atome (Wasserstoffatome) und die roten Kreise stehen für die O-Atome (Sauerstoffatome).
Abbildung 6: Hier sieht man, wie sich ein negatives und ein positives NaCl-Ion von dem Gitter lösen. Das geschieht wegen der zufälligen Teilchenbewegung und der Entropie.
Repetition - Der Merksatz der Entropie: Es passiert das, was wahrscheinlich ist. Die Wahrscheinlickeit, dass sich die Ionen von dem Gitter weg bewegen, anstatt wieder an ihre Ausgangsposition zurückzukehren, ist höher.
Ausserdem umgeben nun die negativen Ionen des Wassermoleküls das positive Natrium-Ion (Von NaCl). Umgekehrt umgeben die positiven Ionen des Wassermoleküls das negative Chlorid-Ion (Von NaCl).
Das passiert aufgrund der Anziehungskräften von negativ und positiv.
Abbildung 7: Hier sieht man nun das teil-hydratisierte NaCl in Wasser.
C) Experiment: Energetische Betrachtung
Vorgehen:
Das Vorgehen bei diesem Experiment ist simpel:
Schritt 1: Man hat die Ursprungstemperatur vom Lösungsmittel (In diesem Fall: Wasser) gemessen und niedergeschrieben.
Schritt 2: Man hat das jeweilige Salz ins Wasser gegeben und die Temperatur, nach der Auflösung des Salzes, nochmals gemessen.
Schlussfolgerung: Wenn sich die Temperatur erhöhte, konnte man rückschliessen, dass die Reaktion exotherm verlaufen ist und Wärmeenergie an das Wasser abgegeben hat, sodass sich die Wassertemperatur erhöhte.
Im Umkehrschluss heisst das auch, wenn sich die Wassertemperatur verringerte, war der Lösungsvorgang des Salzes endotherm. Energie wird, in Form von Wärmeenergie, aus dem Wasser gebraucht, um die Gitterenergie des Salzes zu überwinden.
Ergebnisse:
Es gibt sowohl gut lösliche Salze, die sich exotherm wie endotherm lösen.
Wenn ΔH kleiner als Null ist, hat das System "Energie" aus dem Wasser aufgenommen, um die Gitterenergie des Salzes zu überwinden und hat somit dessen Temperatur gesenkt.
Wenn es eine exotherme Reaktion ist, dann gibt die Reaktion, die Aufbrechung des Gitters, "Energie" an das umliegende Wasser ab, die Temperatur steigt und ΔH ist grösser als Null.
Bei schlecht löslichen Salzen ist die Gitterenergie zu gross und kann nicht überwunden werden.
D) Faktoren, welche die Löslichkeit beeinflussen
Ausgangslage
2. Welche Faktoren bestimmen die Löslichkeit ?
Gut lösliche Salze:
Die Hydrationsenergie ist höher als die Gitterenergie.
Die Reaktion ist exotherm.
Eine günstige Entropie ist vorhanden.
Mittel-Gut lösliche Salze:
Die Gitterenergie ist leicht höher als die Hydrationsenergie.
Diese Art von Reaktionen sind oft endotherm
Eine günstige Entropie ist vorhanden.
Hier kann die Gitterenergie nur durch die günstige Entropie überwunden werden, da diese der Hydrationsenergie hilft.
Nicht / kaum lösliche Salze:
Die Gitterenergie ist sehr gross. - viel grösser als die Hydrationsenergie - Somit ist es fast unmöglich das Gitter aufzubrechen.
Siehe Abbildung in "C) Experiment: Energetische Betrachtung"
Ionengrösse und -ladung: (in Gitterenergie enthalten)
Kleine Ionen:
Kleinere Ionen haben höhere Ladungsdichten (Ladung pro Volumeneinheit), was zu stärkeren elektrostatischen Anziehungskräften zwischen den Ionen führt. Diese stärkeren Kräfte machen es schwieriger, das Ionengitter zu brechen und die Ionen in Lösung zu bringen.
Höhere Ladungen:
Ionen mit höherer Ladung (z.B. Al³⁺ oder Fe³⁺) haben ebenfalls stärkere elektrostatische Anziehungskräfte im Ionengitter, was die Löslichkeit verringert. Dies ist darauf zurückzuführen, dass mehr Energie erforderlich ist, um diese starken Anziehungskräfte zu überwinden und die Ionen in Lösung zu bringen.
Grosse Ionen mit kleinen Ladungen sind also besser löslich als kleine Ionen mit grossen Ladungen.
E) Kristallwasser
Unter Kristallwasser versteht man Wasser, das im Kristallgitter eines Salzes eingebaut ist.
Viele Salze bilden Hydrate, in denen Wassermoleküle in die Kristallstruktur integriert sind.
Ein bekanntes Beispiel für ein solches Hydrat ist Cobalt(II)-chlorid-Hexahydrat (Geheimtinte).
Bsp.: Geheimtinte
Co2+Cl21- * 6H2O(s)
Cobalt bildet mit 6 Wassermolekülen ein Komplexion:
[CO(6H2O)6]2+
Im Cobaltchlorid Hexahydrat ist jetzt dieses Komplexion und noch zwei Chlor-Ionen enthalten.
Und zwar ist jedes Cobalt-Ion von 8 Gegen-Ionen umgeben, zwei davon Chlor-Ionen und sechs Wassermoleküle.
Geheimtinte wird sichtbar, sobald man ein damit beschriebenes Blatt erhitzt.
| CO2+CL21- * 6H2O(s) | → | CO2+CL21-(s) + 6H2O(g) |
| Cobaltchlorid Hexahydrat | Cobaltchlorid(Wasserfrei) |
Abbildungen:
Abb. 1 (links): Hier sieht man das Kristallwasser ( Cobalt(II)-chlorid-Hexahydrat ), welche vor dem Erhitzen auf ein Blatt Papier aufgetragen wurde.
Abb. 2 (rechts): Hier sieht man das nun sichtbare Kristallwasser (Geheimtinte), nach dem Erhitzen auf einer Herdplatte.
Vorgang:
Wenn das Kristallwasser im Ionengitter verdampft, bleibt Cobaltchlorid übrig und wird sichtbar.
Sobald das Kristallwasser verdampft, verwandelt sich das kaum sichtbare (hell-rosa) Cobalt(II)-chlorid-Hexahydrat in sichtbar blaues Cobalt(II)-chlorid.
Dadurch wird die "unsichtbare" Schrift sichtbar und daher kommt der Name: Geheimtinte.
F) Exsikkator
Definition:
Ein Exsikkator ist ein Gerät, das in Laboren zur Aufbewahrung von Proben in einer trockenen Umgebung verwendet wird. Es wird eingesetzt, um zu verhindern, dass Feuchtigkeit in die Proben eindringt, was deren Eigenschaften verändern könnte.
Hauptbestandteile:
Deckel: Oft aus Glas oder Kunststoff, dicht verschliessbar, um die Proben vor Luftfeuchtigkeit zu schützen.
Boden: Ebenfalls aus Glas oder Kunststoff, manchmal mit einem herausnehmbaren Rost oder einer perforierten Platte.
Trockenmittel: In der Regel Silikagel oder andere Substanzen, die Wasser gut uafnehmen können, die in einem separaten Fach oder direkt am Boden des Exsikkators platziert werden.
Vakuumanschluss (optional): Einige Exsikkatoren sind mit einem Anschluss für eine Vakuumpumpe ausgestattet, um ein Vakuum zu erzeugen und die Feuchtigkeit noch effektiver zu entfernen.
(siehe Abb. 2)
Funktionsweise:
Probenlagerung: Proben werden auf dem Rost oder der perforierten Platte platziert.
Verschliessen: Der Deckel wird dicht verschlossen, oft mit einem speziellen Fett oder einer Dichtung, um die Abdichtung zu verbessern.
Feuchtigkeitsentzug: Das Trockenmittel absorbiert die Feuchtigkeit aus der Luft im Inneren des Exsikkators.
Vakuum (optional): Bei Exsikkatoren mit Vakuumanschluss kann die Luft entfernt werden, um die Trocknung zu beschleunigen.
Abb. 1: Hier sieht man:
Rechts: Das Trockenmittel Blaugel vor der Aufnahme von Feuchtigkeit.
Links: Das Trockenmittel Blaugel nach der Aufnahme von Feuchtigkeit.
(Nach der Aufnahme von Feuchtigkeit kann man das Blaugel z.B. mithilfe eines Trockenschranks bei ca. 60°Grad trocknen.)
Abb. 2: Hier sieht man einen einfachen Exsikkator.
Wichtig: Zu beachten ist, dass Exsikkatoren an Schweizer Schulen nicht mehr erlaubt sind.
Quellen
- Chemienotizen des 2. Jahres an der KsBa
- Chemiebuch
- Bilder von Herrn Deuber
- BingAI inkl. Quellenangaben