Grundlagen: Unterschied zwischen den Versionen
(→Neutralisationsreaktionen) |
(→Neutralisationsreaktionen) |
||
| Zeile 51: | Zeile 51: | ||
==== Neutralisationsreaktionen ==== | ==== Neutralisationsreaktionen ==== | ||
| − | HCl + Na<sup>+</sup>OH<sup>-</sup> | + | HCl + Na<sup>+</sup>OH<sup>-</sup> ⇌ H<sub>2</sub>O + Na<sup>+</sup>Cl<sup>-</sup> |
Eine Base und eine Säure neutralisieren sich gegenseitig. Typisch hierfür ist die Reaktion von OH<sup>-</sup>-Ionen mit starken Säuren. Somit entsteht das dazu korrespondierende Säure-Basen-Paar, also Wasser und ein Salz, in diesem Fall Natriumchlorid. | Eine Base und eine Säure neutralisieren sich gegenseitig. Typisch hierfür ist die Reaktion von OH<sup>-</sup>-Ionen mit starken Säuren. Somit entsteht das dazu korrespondierende Säure-Basen-Paar, also Wasser und ein Salz, in diesem Fall Natriumchlorid. | ||
Version vom 1. Juni 2024, 20:10 Uhr
Inhaltsverzeichnis
Säure-Base-Reaktion
Eine Säure ist ein (H+)Protonenspender und eine Base ist ein (H+)Protonenempfänger. Eine Säure-Base-Reaktion ist eine Protonenübertragungsreaktion zwischen einer Säure und einer Base, die miteinander reagieren, auch Protolyse genannt. Dabei gibt die Säure ein Proton, ein H+, ab während die Base dieses Proton aufnimmt.
Anhand dieser Säure-Base-Reaktion sieht man, wie der Protonenübergang verläuft.
Säure: HNO3 + Base: NH3 ⇌ Base: NO3- + Säure: NH4+
[[Datei:Kraefteverhältnis-Protonenübergang.jpeg]|200px|thumb|left|Alternativer Text]]
Sauerstoff ist ein Elektronendieb und Wasserstoff ein Elektronenopfer. Zudem heisst Sauerstoff nicht Sauerstoff, weil er sauer ist, sondern weil er Stoffe, mit denen er reagiert, sauer macht. Die Kräft in diesem Fall ziehen stark an den O-Atome. Da diese aber weiter weg vom H+ sind und ein freies Elektronenwolkenpaar zur Verfügung steht, wobei auch NH3 ein polares Molekül ist.
Ein H+ kann jedoch nur abgegeben werden, wenn das Elektron des H sehr stark angezogen ist und das H somit leicht von der Säure getrennt werden kann. Je polarer die H-Bindung, desto stärker die Säure.. Die Säure wird nach Abgabe eines Protons zu einer Base, die Base hingegen nach der Aufnahme eben dieses Protons zu einer Säure. Dadurch wird auch klar, dass jede Säure eine sogenannte konjugierte Base hat, als auch jede Base eine konjugierte Säure hat, z.B. HNO3 (Salpetersäure) wird zu NO3- (Nitrat-Ion) und umgekehrt. Manche Stoffe können sowohl eine Säure als auch eine Base sein - diese nennt man Ampholyte. Ein wichtiges Beispiel dafür ist H2O (wichtig für den pH-Wert). Ob ein Ampholyt als Säure oder als Base reagiert hängt von dessen Reaktionspartner ab: Es reagiert immer die stärkste Säure mit der stärksten Base. So wird Wasser, wenn es mit einer Säure reagiert, zu einer Base und es entsteht H3O+ (siehe dazu Der pH-Wert), während bei einer Reaktion mit einer Base OH- entsteht und die Base selbst zu einer Säure wird.
Ausserdem sind die Säuren häufig in Wasser gelöst, dies bezeichnet man mit dem Kürzel (aq). Protolysen sind Gleichgewichtsreaktionen, also wird aus einer Säure eine Base und daraus wieder eine Säure. Das Gleichgewicht liegt dabei auf der Seite der schwächeren Säure und der schwächeren Base, dies müssen nicht immer die Edukte sein sondern das Gleichgewicht kann auch auf der Seite der Produkte liegen.
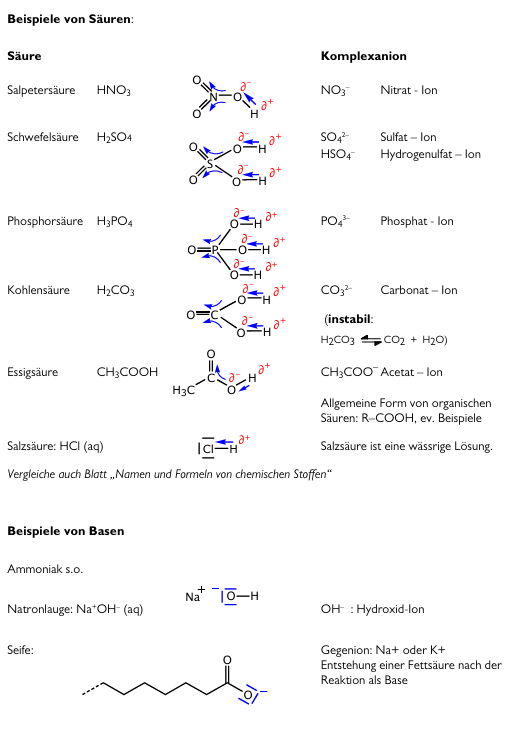
Beispiele von Säure und Basen mit Lewisformel
Beweis für die Protonenübergabe bei Säure-Base-Reaktionen
In diesem Experiment wird reine Essigsäure mit Wasser gemischt:
CH3COOH + H2O ⇌ CH3COO- + H3O+
[[Datei:Kräfteverhältnis-Protonenübergang.jpeg]|200px|thumb|left|Kräfteverhältnis und Protonenübergang]]
| Reine Essigsäure | CH3COOH | nicht elektrisch leitfähig |
| Wasser | H2O | nicht elektrisch leitfähig |
| Acetat-Ion | CH3COO- + H3O+ | elektrisch leitfähig |
Damit ein Stoff leitfähig ist, muss folgende Bedingung erfüllt sein: Es müssen frei bewegliche, geladene Teilchen vorhanden sein. Damit also dieses Gemisch leitfähig ist, müssen entweder frei bewegliche Elektronen oder Protonen verfügbar sein, was in diesem Fall so ist. Reine Essigsäure und Wasser haben jeweils keine frei bewegliche geladene Teilchen. Es ist somit also ein Beweis dafür, dass in einer Säure-Base-Reaktion Protonen den Besitzer wechseln.
Wasser selbst ist durch die Autoprotolyse auch leicht leitfähig:
2 H2O ⇌ H3O+ + OH-
Reaktionstypen
Es gibt vier Säure-Base-Reaktionstypen:
Neutralisationsreaktionen
HCl + Na+OH- ⇌ H2O + Na+Cl-
Eine Base und eine Säure neutralisieren sich gegenseitig. Typisch hierfür ist die Reaktion von OH--Ionen mit starken Säuren. Somit entsteht das dazu korrespondierende Säure-Basen-Paar, also Wasser und ein Salz, in diesem Fall Natriumchlorid.
"Die starke Säure vertreibt die schwächere Säure aus ihrem Salz"
K+CN- + HClaq ⇌ K+Claq- + HCN
Kalknachweis:
Wenn aus Carbonat-Ion (CO32-) ein Kohlensäure (H2CO3) entsteht, so kann man dies auch in der Geologie verwenden. CO32- kann mit Ca2+ reagieren und es entsteht Kalk Ca2+CO32-. Dies kann man dann mit einer starken Säure reagieren lassen, zum Beispiel HCl:
Ca2+CO32- + 2HClaq ⇌ H2CO3 + Ca2+Cl2-
Basen im Wasser
NH3 + H2O ⇌ NH4+ + OH-
Hierbei wird dem Wasser das H+ weggenommen. Daher entsteht ein OH-.
Dies wird auch später wichtig sein um den pOH (Gegenstück des pH-Wertes) zu bestimmen, da dies in der Anzahl OH--Ionen gemessen wird. Logischerweise hat es mehr OH-, wenn es auch mehr Base hat.
Säuren im Wasser
HCl + H2O ⇌ Cl+ + H3O+
Einige Säuren und ihre konjugierten Basen
Säuren werden nach der Abgabe eines Protons zu einer Base und Basen werden nach der Aufnahme dieses Protons zu einer Säure. Dadurch wird auch klar, dass jede Säure eine sogenannte konjugierte Base hat, als auch jede Base eine konjugierte Säure besitzt. Hier sind Säuren mit ihren jeweiligen konjugierten Basen:
| Iodwasserstoff: HI | Salpetersäure: HNO3 | Nitrat-Ion: NO3- |
| Kohlensäure: H2CO3 | Hydrogencarbonat-Ion: HCO3- | |
| Hydrogencarbonat: HCO3- (Ampholyt!) | Carbonat-Ion: CO32- | |
| Phosphorsäure: H3PO4 (daraus:H2PO4- und H1PO42-, Ampholyte) | Phosphat-Ion: PO43- | |
| Oxonium: H3O+ | Wasser: H2O | |
| Wasser: H2O | Hydroxid-Ion: OH- | |
| Hydroxid-Ion: OH- | Oxid-Ion: O 2- | |
| Essigsäure: CH3COOH | Acetat-Ion: CH3COO |
Die Essigsäure gehört zu der Gruppe der organischen Säuren, welche jeweils eher schwach sind. Praktisch immer ist eine Carboxylgruppe vorhanden (COOH), der Rest variiert. Schwache organische Säuren finden auch zur Bestimmung des pH-Wertes eine Funktion, wenn die konjugierte Base eine andere Farbe hat als die Säure. Wenn eine Base (oder auch ein Ampholyt) negativ geladen ist, können sie auch mit einem Metall binden und dadurch zu einem Salz werden, z.B. Kalk (Ca2+CO32-).
Ampholyten
Ampholyten sind Stoffe, die ein H+ Proton abgeben, aber auch aufnehmen können. Das heisst sie können als Säure, wie auch als Base reagieren.
Zusammenfassung: Video von the Simple Chemics
Wie reagieren Säuren? Säure-Base-Paare
Link: Säure-Base Paare REMAKE
Im Video wird zuerst erklärt, was eine Säure bzw. eine Base genau ist. Dann werden einige Beispiele dafür gennant. Wie genau eine Säure bzw. eine Base reagiert wird anhand zweier Beispiele von Reaktionen mit Wasser gezeigt. Dabei wird immer das konjugierte Säure-Base-Paar genannt.
Zu beachten:
- Zu Beginn des Videos wird erwähnt, dass sich die Oxidationszahlen bei Säure-Base-Reaktionen nicht ändern. Das ist jedoch zum Verständnis von diesen Protolysen nicht relevant.
- Bei der Definition im Video werden die Begriffe «Protonendonator» und «Protonenakzeptor» genannt. Im Unterricht haben wir dafür die Begriffe «Protonenspender» und «Protonenempfänger» benutzt.
- Die Säure wird im Video als "gutherziger Spender" und die Base als "Bettler" beschrieben, da die Säure ein H+ an die Base abgibt. Die eigentliche Erklärung dafür ist jedoch das freie Elektronenpaar der Base, welches das Proton der Säure anziehen. Die Säure gibt das Proton nicht freiwillig ab, es wird ihr von der Base "gestohlen".
- Der Begriff «konjugiertes Säure-Basen-Paar» wird zwar erwähnt, jedoch ist nicht klar definiert, was damit gemeint ist. Unter einem konjugierten Säure-Base-Paar versteht man eine Säure und deren dazugehörige Base. Die Säure unterscheidet sich jeweils um ein H+ von der Base, die Säure hat also jeweils ein Proton mehr als die Base. Die Säure gibt das Proton dann ab und daraus entsteht die konjugierte Base mit einem Proton weniger.
- Das Video erwähnt den Begriff «Ampholyt» nicht. Es gibt zwei Reaktionen mit Wasser, einmal reagiert es mit einer Base, das andere Mal mit einer Säure. Dabei ist es wichtig in Erinnerung zu behalten, dass Wasser sowohl als Säure als auch als Base reagieren kann, da es ein Ampholyt ist.
Besonders nützlich: Das Video eignet sich sehr gut als Einführung in das Thema. Es erklärt das Prinzip der Säure-Base Reaktion einfach und gut verständlich.
Zusätzliche Informationen: Brönsted ist der Urheber der Säure-Basen Theorie, wie wir sie heute kennen. Davor haben die Wissenschaftler geglaubt, dass Stoffe nur mit Wasser sauer oder basisch reagieren können. Brönsted hat gezeigt, dass auch eine Reaktion ohne Wasser eine S/B-Reaktion sein kann.
Quellen
- Text: eigene Notizen
- Bild: Wikipedia
- Video: The Simple Chemics