Die Oktettregel und ihre Ausnahmen: Unterschied zwischen den Versionen
| Zeile 4: | Zeile 4: | ||
== Einführung == | == Einführung == | ||
| − | Als Oktettregel versteht man in der Chemie ein Gesetz, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist eben unter anderem auf die sogenannte Oktettregel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Atome ihre Valenzelektronen (siehe: [http://www.rdeuber.ch/chemiewiki/index.php?title=Einfache_Molek%C3%BCle]). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben kann und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht | + | Als Oktettregel versteht man in der Chemie ein Gesetz, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist eben unter anderem auf die sogenannte Oktettregel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Atome ihre Valenzelektronen (siehe: [http://www.rdeuber.ch/chemiewiki/index.php?title=Einfache_Molek%C3%BCle]). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben kann und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht (daher auch der Name Oktett => 8), so ist dieses Teilchen in einem stabileren Zustand. Diese Regel kann man auf fast alle Bindungen zurückführen. Hier einige Beispiele mithilfe der Lewisformel: |
| − | |||
| + | |||
| + | [[Datei:oktettregel_bsp.png|500px| Abb. 1: Atome teilen Elektronen für eine volle Valenzschale]] | ||
| + | |||
| + | |||
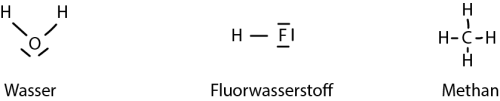
| + | Hierbei sieht man, dass die beteiligten Atome der Bindung eine volle Valenzschale erreichen. Wichtig ist, dass geteilte Elektronen zu beiden Atomen gezählt werden muss. Somit erhält bei der Wasser-Verbindung der Sauerstoff jeweils ein zusätzliches Elektron der Wasserstoff-Atome, aber auch das Wasserstoff-Atom teilt mit dem Sauerstoff ein Elektron, womit es eine volle Valenzschale erreicht mit zwei Elektronen. Dasselbe Prinzip gilt foglich auch für Fluorwasserstoff und Methan. | ||
== Ausnahmen == | == Ausnahmen == | ||
| Zeile 18: | Zeile 22: | ||
=== Radikale === | === Radikale === | ||
| − | Radikale sind Atome, welche mindestens eine einfach besetzte Elektronenwolke besitzen, wie zum Beispiel Stickstoff. | + | Radikale sind Atome, welche mindestens eine einfach besetzte Elektronenwolke besitzen, wie zum Beispiel Stickstoff. |
| + | ... | ||
| − | === Wasserstoff, Helium === | + | '''Exkurs: Radikale im Körper und Vitamine''' |
| + | |||
| + | |||
| + | |||
| + | === Wasserstoff, Helium, Edelgase === | ||
[[Datei:helium_element.png|150px|thumb|right| Abb. 1: Helium Atom mit vollständig besetzter Valenzschale]] | [[Datei:helium_element.png|150px|thumb|right| Abb. 1: Helium Atom mit vollständig besetzter Valenzschale]] | ||
Bei diesen zwei Elementen trifft die Oktettregel nicht zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist. | Bei diesen zwei Elementen trifft die Oktettregel nicht zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist. | ||
| + | |||
| + | Des Weiteren besitzen die Elemente der 8. Hauptgruppe des Periodensystems bereits alle 8 Valenzelektronen. Diese Atome erfüllen also bereits die Oktettregel und gehen somit nur sehr schwer Bindungen mit anderen Atomen ein (grosser Energieaufwand), da das Atom alleine schon in einem energetisch sehr stabilen Zustand ist. | ||
=== Starke Elektronenräuber === | === Starke Elektronenräuber === | ||
== Quellen == | == Quellen == | ||
Version vom 28. Mai 2020, 20:36 Uhr
Inhaltsverzeichnis
Die Oktettregel und ihre Ausnahmen
Einführung
Als Oktettregel versteht man in der Chemie ein Gesetz, welches den Aufbau von Molekülen, bzw. Atomen beschreibt und begründet. Der Grund, warum sich Atome binden, ist eben unter anderem auf die sogenannte Oktettregel zurückzuführen. Wenn ein Molekül entsteht, teilen sich die jeweiligen Atome ihre Valenzelektronen (siehe: [1]). Die Oktettregel besagt, dass ein Atom maximal 8 Elektronen in der äussersten Schale haben kann und diesen Zustand auch anstrebt, da die Nichtmetalle eine starke Anziehungskraft auf Elektronen ausüben. Wenn ein Atom also durch Bindung mit anderen Atomen die 8 Valenzelektronen erreicht (daher auch der Name Oktett => 8), so ist dieses Teilchen in einem stabileren Zustand. Diese Regel kann man auf fast alle Bindungen zurückführen. Hier einige Beispiele mithilfe der Lewisformel:
Hierbei sieht man, dass die beteiligten Atome der Bindung eine volle Valenzschale erreichen. Wichtig ist, dass geteilte Elektronen zu beiden Atomen gezählt werden muss. Somit erhält bei der Wasser-Verbindung der Sauerstoff jeweils ein zusätzliches Elektron der Wasserstoff-Atome, aber auch das Wasserstoff-Atom teilt mit dem Sauerstoff ein Elektron, womit es eine volle Valenzschale erreicht mit zwei Elektronen. Dasselbe Prinzip gilt foglich auch für Fluorwasserstoff und Methan.
Ausnahmen
Doch leider gibt es keine Regeln ohne Ausnahmen. Auch die Oktettregel ist nicht überall anwendbar. Foglich sind die grössten und wichtigsten Ausnahmen aufgelistet.
Halbmetalle
Elemente wie beispielsweise Bor, Silizium, Germanium, etc. sind sogenannte Halbmetalle (im Periodensystem bezeichnet). Halbmetalle haben die Eigenschaft, etrem schwache Anziehungskräfte zu haben. Folglich ist es nicht möglich, dass diese Elemente ganze 8 Valenzelektronen in ihrem Orbit behalten können. Andere Verbindungen mit diesen Elementen sind ausserdem äusserst instabil.
Radikale
Radikale sind Atome, welche mindestens eine einfach besetzte Elektronenwolke besitzen, wie zum Beispiel Stickstoff. ...
Exkurs: Radikale im Körper und Vitamine
Wasserstoff, Helium, Edelgase
Bei diesen zwei Elementen trifft die Oktettregel nicht zu, da sie schlichtweg zu wenige Valenzelektronen besitzen können. Wasserstoff und Helium sind die einzigen zwei Atome in der ersten Periode und somit auch die einzigen zwei, welche maximal zwei Valenzelektronen besitzen können, da die äusserste Schale die K-Schale ist.
Des Weiteren besitzen die Elemente der 8. Hauptgruppe des Periodensystems bereits alle 8 Valenzelektronen. Diese Atome erfüllen also bereits die Oktettregel und gehen somit nur sehr schwer Bindungen mit anderen Atomen ein (grosser Energieaufwand), da das Atom alleine schon in einem energetisch sehr stabilen Zustand ist.