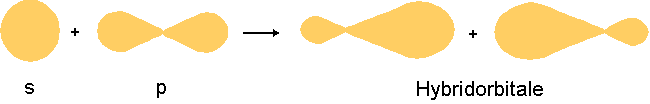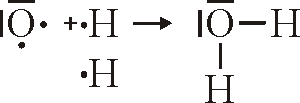Kugelwolkenmodell: Unterschied zwischen den Versionen
| Zeile 16: | Zeile 16: | ||
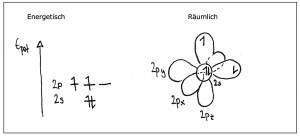
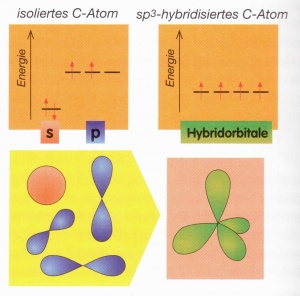
Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] 2s<sup>2</sup>2p<sup>2</sup> | Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] 2s<sup>2</sup>2p<sup>2</sup> | ||
| − | [[Bild:Hybridisierung_Atomorbitale.jpg|300px|Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] | + | [[Bild:Hybridisierung_Atomorbitale.jpg|300px||Energieniveaus und Orbitale eines einzelnen Kohlenstofftoms]] |
Version vom 23. März 2020, 22:10 Uhr
Im Rahmen des Orbitalmodell wird zur Beschreibung und Darstellung von Elektronenpaarbindungen in der Regel das sogenannte Hybridisierungsmodell verwendet. Dieses ist aber in der Anwendung für den gymnasialen Grundlagenfachunterricht zu anspruchsvoll. Im folgenden wird deshalb zwar zuerst das Prinzip des Hybridisierungsmodells erklärt, dann aber das Kugelwolkenmodell als stark vereinfachtes - aber durchaus brauchbares Modell - eingeführt.
Inhaltsverzeichnis
Hybridisierung
Nähern sich zwei Nichtmetallatome, wirken starke Kräfte: - Anziehung zwischen den Kernen und den Elektronen des jeweils anderen Atoms - Abstossung zwischen den Elektronen der beiden negativ geladenen Hüllen und den positiv geladenen Kernen Durch diese Kräfte, werden die s- und p-Orbitale verändert: räumlich und energetisch.
Das s-Orbital verschmilzt dabei mit 1, 2 oder 3 p-Orbitalen, wobei sog. Hybridorbitale entstehen (hybrida (gr): Mischling). Die Gesamtanzahl Orbitale bleibt gleich: Es bleiben insgesamt immer 4 Orbitale.
sp3-Hybridisierung - Beispiel Methan CH4
Ein einzelnes Kohlenstoffatom weist die folgende Elektronenkonfiguration auf: [He] 2s22p2
Beispiel für den Hbridisierungsprozess: Das s-Orbital hybridisert mit einem p-Orbital zu zwei Hybridorbitalen:
Im folgenden werden die drei Hybridisierungsarten am Beispiel des KOhlenstoffatoms gezeigt:
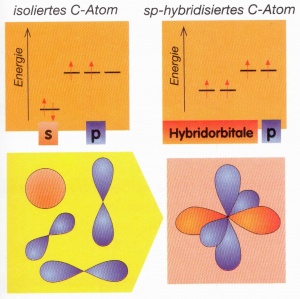
Die sp-Hybridisierung bedeutet, dass jeweils ein s-Orbital und ein p-Orbital mitteinander verschmelzen und dabei ein hybridisiertes Orbital entsteht. Die Energieniveaus der hybridisierten Orbitale sind leicht tiefer gegenüber den anderen Orbitalen.
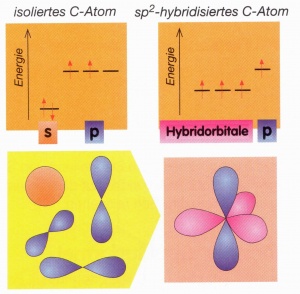
sp2-Hybridisierung
Die sp2-Hybridisierung bedeutet, dass ein s-Orbital und zwei p-Orbitale mitteinander verschmelzen.
Man betrachtet aber der Einfachheit halber nur die sp3-Hybridisierung und vernachlässigt die anderen Hybridisierungsmöglichkeiten. Mit der sp3-Hybridisierung lassen sich Bindungen leichter darstellen.
sp3-Hybridisierung
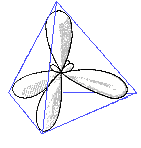
Die sp3-Hybridisierung bedeutet, dass ein s-Orbital und drei p-Orbitale mitteinander verschmelzen und ein sp3-hybridisierte Orbital entsteht, wobei alle vier Orbitale auf dem gleichen Energieniveau liegen.
Wenn man dies im Raum betrachtet sieht man, dass sich die entstandenen Orbitale möglichst weit voneinander entfernen (109.5°). Sie haben eine tetraedische Form:
Dank der Hybridisierung verstehen wir das Kugelwolkenmodell besser und somit ergeben sich ein paar einfache Regeln, durch die das KWM beschrieben werden kann:
- In der ersten Schale gibt es nur eine Kugelwolke, die zentral um den Kern angeordnet ist.
- Ab der zweiten Schale werden immer erst 4 Elektronenwolken angelegt, erst in den Nebengruppen werden sie auf die Endzahl erweitert (allerdings spielt das bei der chemischen Bindung keine Rolle!)
- Jede der vier Elektronenwolken wird aufgrund der Abstoßung der Elektronen zuerst einfach besetzt(Hund'sche Regel). Erst ab dem 5. Elektron auf der Schale sind die Elektronen, bei unterschiedlichem Spin, paarweise in den Elektronenwolken verteilt.(Pauli-Prinzip)
- Die Elektronenwolken versuchen immer einen möglichst großen Abstand zu erreichen, weshalb sie tetraedrisch angeordnet sind.
- Die Besetzung der inneren Schalen wird nicht beachtet, da sie bei der chemischen Bindung keine Rolle spielen.
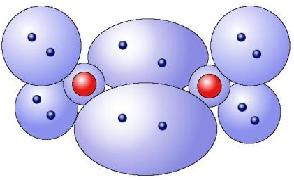
Das Kugelwolkenmodell
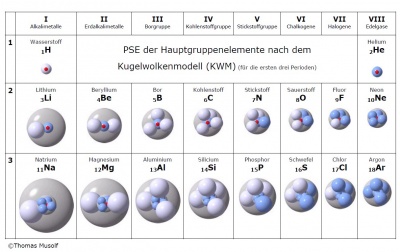
Im Kugelwolkenmodell (KWM) geht man davon aus, dass die Elektronen um ein Atom kugelförmige Aufenthaltsorte haben. Diese Aufenthaltsräume wurden, gemäss Orbitalmodell, mittels Schrödingergleichung errechnet und stellen die Räume als Wahrscheinlichkeitsräume dar, in dem sich ein Elektron aufhält. Jede dieser Elektronenwolken können mit ein oder zwei Elektronen besetzt werden. Aufgrund der zunehmender Grösse der Schalen nehmen auch die Elektronenwolken zu, wobei nicht alle Räume der Wolken besetzt werden müssen. Jedoch betrachtet man im Kugelwolkenmodell nur die äusserste Schale, die Valenzschale, welche, wie schon im Bohrschen Modell festgelegt, bis auf weiteres nur acht Elektronen aufnimmt! Folglich hat jedes Atom im KWM maximal 4 Wolken.
Beispiele zum KWM
Hier folgen zwei Beispiele, an denen man das KWM gut illustrieren und nachvollziehen kann:
|
Wasserstoff (H2): |
Sauerstoff (O2): |
Grenzen des Modells
Es gibt Unregelmäßigkeiten in der tatsächlichen Besetzung von Schalen bei den Nebengruppenelementen, die sich nur bei einer Annahme erklären lassen: Es muss noch Unterschalen geben. Das lässt sich aber mit dem Kugelwolkenmodell nicht mehr erklären, da es ja nur die jeweils die äusserste Schale betrachtet.
Vergleich: KWM - Orbitalmodell
| Kugelwolkenmodell | Orbitalmodell | |
| gleich | Schalen der Atome | Schalen der Atome |
| Elektronen haben Wellencharakter | Elektronen haben Wellencharakter | |
| Hund'sche Regel, Pauli-Prinzip | Hund'sche Regel, Pauli-Prinzip | |
| verschieden | sp3-Hybridisierung | s/p-Unterschalen |
| Betonung der Valenzschalen | Berücksichtigung aller Schalen | |
| Bindungen der 1. und 2. Periode können gut beschrieben werden, ab der 3. Periode nur eingeschränkt. Nicht geeignet für Nebengruppen, da diese teilweise gleich viele Valenzelektronen haben wie Atome mit anderer Anzahl an Elektronen |
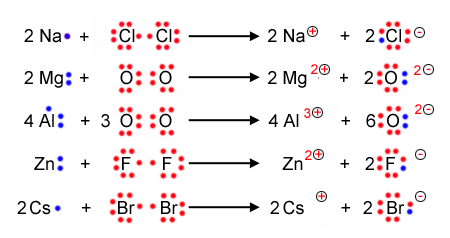
Die Lewisschreibweise
Bei der Lewisschreibweise zeigt man auf einem einfachen weg auf, wieviele Valenzelektronen ein Atom hat, und weiterführend wie die Bindungen zwischen Atomen und Molekülen aussehen. Dabei ersetzt man einfach die vollbesetzetn Kugelwolken durch einen Strich und die einfach besetzten Kugelwolken durch einen Punkt.
Beispiele zur Lewisschreibweise
Hier folgen ein paar Beispiele, an denen man die Schreibweie gut illustrieren und nachvollziehen kann:
Bindung von zwei Cl - Atomen
Bindung von H2O
Man kann statt Strichen auch zwei Punkte schreiben:
Quellen
- http://wikipedia.org
- http://google.com
- Heftaufschrieb
- http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/Wichtige%20Begriffe%20mit%20frame.html
- http://www.bionet.schule.de/~grube/fachlehr/chemie/fundamen/valenz.htm
- http://chemie.fb2.fh-frankfurt.de/Erlaeuterungen/11Hybridisierung-sp3.htm
- http://chemgapedia.de
- http://www.thomasmusolf.de/fuer_schueler_und_eltern/Chemie/Allgemeines/PSE%20-%20online07.jpg
- Elemente-Moleküle; von Roderich Magyar, Wolfgang Liebhart und Gabriela Jelinek