Die Redox-Reihe: Unterschied zwischen den Versionen
| Zeile 17: | Zeile 17: | ||
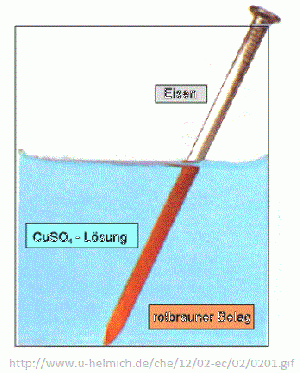
Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, die sich in der Lösung nachweisen lassen. | Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, die sich in der Lösung nachweisen lassen. | ||
| − | |||
[[image:Abb.16_Redox.gif|thumb|right|Versuch Eisennagel]]] | [[image:Abb.16_Redox.gif|thumb|right|Versuch Eisennagel]]] | ||
| Zeile 29: | Zeile 28: | ||
Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten). | Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten). | ||
| − | + | [[image:|thumb|right|Bild eines Antikörpers]]] | |
| − | [[image: | + | |
| + | Alle Metalle mit negativem Standard-Reduktionspotenzial sind unedel, da sie gerne Elektronen abgeben, und sich so auflösen. | ||
| + | Unedle Metalle verwittern, rosten und oxidieren schneller. | ||
| + | |||
| + | ===Reaktion von Nichtmetall-Anionen mit Nichtmetall-Molekülen=== | ||
| + | Redoxpaare vom Typ Nichtmetall-Anion/Nichtmetall-Molekül lassen sich in eine Reihe einordnen. | ||
| + | |||
| + | Beispiel: | ||
| + | Zugabe von Chlor in eine wässrige Lösung von Kaliumbromid ergibt eine Braunfärbung der Flüssigkeit. Dies ist so, weil sich Brom bildet. In der Lösung lassen sich Chlorid-Ionen nachweisen. | ||
| + | |||
| + | bild | ||
| + | |||
| + | Folgende Reaktion findet statt: | ||
| + | |||
| + | Oxidation: 2Br-(aq) -> Br2(aq) + 2e- <br> | ||
| + | Reduktion: Cl2(g) -> 2Cl-(aq) <br> | ||
| + | Redoxreaktion: Cl2(g) + 2Br-(aq) -> Br2(aq) + 2Cl-(aq) <br> | ||
| + | |||
| + | Führt man den umgekehrten Versuch durch mit Brom, das man in eine Kaliumchlorid-Lösung einleitet, so erfolgt keine Reaktion. | ||
| + | Daraus kann man schliessen, dass Chlor das stärkere Oxidationsmittel ist als Brom. Chloratome nehmen leichter Elektronen auf als Bromatome. | ||
| + | Wie bei den Metallen kann weitere Versuche durchführen und erhält so eine Reihe (die Redoxreihe). | ||
| + | |||
Version vom 27. Juni 2017, 17:28 Uhr
Die Redoxreihe ist eine Auflistung von Elementen, die zusammen Redox-Paare bilden. Die Redoxpaare werden nach ihrem Redoxpotential unter Standardbedingungen (Druck=1atm, Temperatur= 298,15K, Aktivität=1) sortiert. Aus der Redoxreihe lässt sich das Redoxverhalten eines Stoffes herauslesen. So kann jede Redoxreaktion durch zwei Paare beschreiben werden und die Richtung von Reaktionen vorausgesagt werden.
Inhaltsverzeichnis
Die Redox-Reihe
Korrespondierende Redoxpaare
Redox-Paar: Ein Reduktionsmittel wird durch Elektronenabgabe zum korrespondierenden Oxidationsmittel. Dabei wird immer die oxidierte Form zuerst angegeben. Beispiel: Fe2 → Fe3 + e- Reduktionsmittel und Oxidationsmittel einer Redoxreaktion bilden ein korrespondierendes Redoxpaar.
Redoxpotential: Die Summe des Oxidationspotentials und des Reduktionspotentials. Je „lieber“ ein Partner oxidiert wird und je „lieber“ der andere reduziert wird, desto grösser ist deren gemeinsames Redoxpotential. Das Redoxpotential beschreibt somit die Bereitschaft, Elektronen abzugeben und dadurch in die oxidierte Form überzugehen, bzw. Elektronen aufzunehmen und dadurch in die reduzierte Form überzugehen.
Die Reaktionen von Metall-Atomen mit Metall-Kationen
Die Fähigkeit zur Elektronenabgabe – das Reduktionsvermögen – ist unterschiedlich ausgeprägt. Beispiel: Ein Eisennagel wird in eine Kupfer(II)-sulfat-Lösung getaucht. Es scheidet sich Kupfer auf dem Eisen ab, die sich in der Lösung nachweisen lassen.
]
Dabei läuft die folgende Reaktion ab:
Oxidation: Fe(s) → Fe2+(aq) + 2e-
Reduktion: Cu2+(aq)+2e- → Cu(s)
Redoxreaktion: Fe(s) + Cu2+(aq) → Fe2+(aq) + Cu(s)
Wenn man den Versuch umgekehrt macht, also ein Stück Kupferblech in eine Eisensulfat-Lösung gibt, läuft keine Reaktion ab. Eisen ist von den beiden Metallen das stärkere Reduktionsmittel. Man sagt auch, Eisen ist „unedler“ als Kupfer.
Mit weiteren Versuchen kann man eine Reihe von Metallen testen und erhält so eine Redoxreihe der Metalle (siehe unten).
[[image:|thumb|right|Bild eines Antikörpers]]]
Alle Metalle mit negativem Standard-Reduktionspotenzial sind unedel, da sie gerne Elektronen abgeben, und sich so auflösen. Unedle Metalle verwittern, rosten und oxidieren schneller.
Reaktion von Nichtmetall-Anionen mit Nichtmetall-Molekülen
Redoxpaare vom Typ Nichtmetall-Anion/Nichtmetall-Molekül lassen sich in eine Reihe einordnen.
Beispiel: Zugabe von Chlor in eine wässrige Lösung von Kaliumbromid ergibt eine Braunfärbung der Flüssigkeit. Dies ist so, weil sich Brom bildet. In der Lösung lassen sich Chlorid-Ionen nachweisen.
bild
Folgende Reaktion findet statt:
Oxidation: 2Br-(aq) -> Br2(aq) + 2e-
Reduktion: Cl2(g) -> 2Cl-(aq)
Redoxreaktion: Cl2(g) + 2Br-(aq) -> Br2(aq) + 2Cl-(aq)
Führt man den umgekehrten Versuch durch mit Brom, das man in eine Kaliumchlorid-Lösung einleitet, so erfolgt keine Reaktion. Daraus kann man schliessen, dass Chlor das stärkere Oxidationsmittel ist als Brom. Chloratome nehmen leichter Elektronen auf als Bromatome. Wie bei den Metallen kann weitere Versuche durchführen und erhält so eine Reihe (die Redoxreihe).
So wird ein Link inerhalb des Wikis gemacht:
Hier gehts zu den I Grundlagen
Erster Unteruntertitel
So wird eine chemische Formel geschrieben:
Zweiter Titel
Pfeil: →
Gleichgewichtspfeil: ⇌
Quellen
- Chemieunterlagen
Weblinks
- Swisseduc – Unterrichtsserver für Chemie
- Mediawiki Hilfeseite – So kann der Link näher beschrieben werden