IX Seifensieden nach Kaltverfahren: Unterschied zwischen den Versionen
(→Waschwirkung von Seifen) |
(→Bildnachweis) |
||
| Zeile 105: | Zeile 105: | ||
*Abb.7 (rechter Teil): [http://www.klassewasser.de/content/language1/html/6057.php] | *Abb.7 (rechter Teil): [http://www.klassewasser.de/content/language1/html/6057.php] | ||
| − | + | ---- | |
| + | |||
| + | 24.6.2015 Kay Tobler | ||
Version vom 24. Juni 2015, 18:37 Uhr
Inhaltsverzeichnis
Einleitung
Bereits um 2500 v. Chr. hatten die Sumerer ein erstes seifenartiges Reinigungsmittel, deren chemisches Rezept von Ägyptern und Griechen übernommen wurde. Es gibt zwei Arten von Seifen, einerseits die Kernseifen, bei denen es sich um Natriumsalze von Fettsäuren handelt, andererseits die Schmierseifen, die aus Kaliumsalzen von Fettsäuren bestehen. Als Waschmittel für Textilien haben sie allerdings ihre Bedeutung verloren, da sie in härterem Wasser unlösliche Calcium- und Magnesiumsalze bilden. Bei der Körperreinigung sind sie immer noch hoch im Kurs. Bei einem Duschvorgang ohne Seife kann die dünne Fettschicht der Haut nicht durchbrochen werden, aber genau dort binden sich diverse Staubpartikel, Bakterien und chemische Stoffe.
Theorie
Verseifung
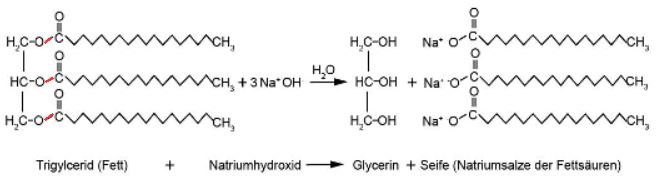
Moderne, handgemachte Seifen werden aus verschiedenen Pflanzenölen und Fetten hergestellt. Zur Verseifung wird meistens Natronlauge (NaOH-Lösung) gebraucht. Gibt man die Natriumhydroxid-Lösung mit dem Fett zusammen, spaltet sich das Fett in Glycerin und in die Natriumsalze der Fettsäuren, wobei es sich bei den Salzen um die Seife handelt.
Abb.2: Die Esterbindungen (rot) im Fettmolekül werden durch die Natronlauge geknackt. Reaktionsgleichung: C57H110O6 + 3NaOH(aq) → C3H8O3 + 3C18H35NaO2
Strukturell gesehen handelt es sich bei Seifen um Salze. Na+- oder K+-Ionen sind die Kationen, die konjugierten Basen der Fettsäuren (langkettige Carbonsäuren mit oder ohne Doppelbindungen) fungieren als Anionen. Bei der Seife in Abbildung 2 handelt es sich um Natriumstearat C18H35NaO2.
Seifensieden nach Kaltverfahren
Der Prozess der Verseifung im Kaltverfahren läuft bei Temperaturen bis maximal 80°C ab. Fett und Lauge werden zusammen gegeben und und mit dem Stabmixer vermischt. Es bildet sich eine Emulsion, die immer dicker und puddingartiger wird. Nach der Zugabe von Duft- und Farbstoffen wird die Seife in eine Form gegossen, gut isoliert und ruhen gelassen. In den nächsten 24 bis 48 Stunden läuft die „Gelphase“ ab. Bei Temperaturen bis 80°C findet die eigentliche Verseifung statt, die Seife schmilzt und sieht glasig aus. In den drauf folgenden Tagen schneidet man die Seife in Stücke und lässt sie mindestens 6 Wochen trocknen. Eine junge Seife hat einen pH-Wert zwischen 11 und 12. Dieser sinkt aber nach einigen Tagen auf 9 bis 10. Als Nebenprodukt fällt Glycerin an, welches aufgrund seiner hautfreundlichen und Feuchtigkeit erhaltenden Eigenschaften, im Reaktionsgemisch gelassen wird.
Experimenteller Teil
Achtung: Natronlauge ist stark ätzend, immer mit Brille und Handschuhe arbeiten!
Vorbereitung
A
- Wasser in ein Becherglas geben.
- Natriumhydroxid in ein zweites Becherglas geben.
- Unter dem Abzug vorsichtig, unter ständigem Rühren, die Natriumhydroxid ins Becherglas mit dem Wasser geben. Rühren bis das gesamte NaOH gelöst ist.
- Unter dem Abzug auf 30-50°C abkühlen lassen.
B
- Margarine und Kokosfett in ein Becherglas geben und unter ständigem Rühren bei maximal 80°C schmelzen.
- Rapsöl beigeben
- Sonnenblumenöl beigeben
- Die Lösung auf 30-50°C abkühlen lassen.
Verseifung
- Abgekühlte Natriumhydroxid-Lösung unter langsamen Rühren ins Becherglas mit dem Fett geben.
- Mit dem Stabmixer zu leichtem Andicken bringen → Mischung wird Vanille-Pudding ähnlich.
- Eine Pasteurpipette Parfümöl zugeben, mit dem Glasstab gut verrühren.
- Farbstoff wählen, in Plastikbecher geben, mit wenig Seifenmasse aufschlämmen, restliche Seifenmasse zugeben mit Glasstab verrühren.
- Mischung in die mit Backpapier ausgelegte Form geben.
- Nach einer Woche aus der Form nehmen, zuschneiden und mind. 4 Wochen lang an einem luftigen Ort trocknen lassen.
Wissenswertes über Fette und Seifen
Fette und Fettsäuren
Fette sind Ester des Glycerins mit drei meist verschiedenen Carbonsäuren, den Fettsäuren. Tierische Fette bestehen vorwiegend aus langkettigen gesättigten (=keine Doppelbindungen) Carbonsäuren, pflanzliche vorwiegend aus kurzkettigen, ungesättigten Fettsäuren. Fette, deren Carbonsäuren gesättigt sind und die mehr als 10 Kohlenstoffatomen in den C-Ketten der Fettsäurereste aufweisen, sind bei Raumtemperatur fest (Schmelzpunkt höher als 20°C). Fette mit einem höheren Anteil an ungesättigten Fettsäuren und/oder kürzeren Fettsäureresten sind flüssig und werden fette Öle genannt.
Einige Beispiele von Fettsäuren:
Waschwirkung von Seifen
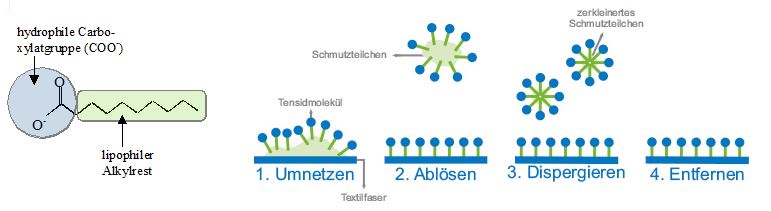
Eine Reinigung von z.B. verschmutzter Kleidung mit Wasser allein ist in den seltensten Fällen ausreichend. Zum Einen durchnässt reines Wasser aufgrund seiner hohen Grenzflächenspannung Wäschestücke nur ungenügend, zum Anderen können hydrophobe Verunreinigungen wie Fette, Eiweisse oder Stärke nicht entfernt werden. Durch Zugabe von Seife werden beide Probleme gelöst. Der lange unpolare Alkylrest des Seifenanions ist lipophil („fettliebend“), dessen Carboxylatgruppe (COO-) hydrophil („wasserliebend“); der amphiphile („beides liebend“) Charakter der Seifenanionen ist der Schlüssel zu deren Waschwirkung. Die Seifenanionen lagern sich an der Wassergrenze an, wobei ihr lipophiler Teil vom Wasser wegweist, der hydrophil Teil dem Wasser zugewandt ist. Da unter den Seifenanionen viel schwächere zwischenmolekulare Kräfte wirken als zwischen Wassermolekülen (Wasserstoffbrücken) wird die Grenzflächenspannung herabgesetzt und die Seifenlösung kann tief ins Gewebe eines Stoffs eindringen. Hydrophobe Schmutzpartikel werden von Seifenanionen umschlossen, wobei diese ihren lipophilen Teil den Schmutzpartikel zuwenden, den hydrophilen Teil zeigt zum Wasser hin. So können die Schmutzpartikel abgelöst, verkleinert (dispergiert) und entfernt werden (siehe Abb.7).
Abb.7: Wirkungsweise von Seifemolekülen (Tensidmolekülen) beim Waschprozess
Quellen
- Unterlagen: GLF Praktikum
- 09 Seife Herstellen.pdf
- Werner Eisner u.a.: Elemente. Klett und Balmer Verlag, Zug, 5. Auflage 2013.
- www.wikipedia.org
Bildnachweis
24.6.2015 Kay Tobler