Der pH-Wert: Unterschied zwischen den Versionen
(→Grenzbereich des pH-Wertes) |
Ganflo (Diskussion | Beiträge) |
||
| Zeile 31: | Zeile 31: | ||
==Grenzbereich des pH-Wertes== | ==Grenzbereich des pH-Wertes== | ||
| − | [[Bild:Phwert.gif|thumb|right| | + | [[Bild:Phwert.gif|thumb|right|525px|ph-Werte Skala]] |
| − | Da KW=[ | + | Da KW = [H<sub>3</sub>O<sup>+</sup>] * [OH<sup> -</sup>] = 10 <Sup>-14 </sup> konstant bleibt, ist die maximal mögliche Konzentration 10<sup>0 </sup> (=1) * 10 <Sup>-14 </sup> = 10 <Sup>-14 </sup> und die minimal mögliche Konzentration 10 <Sup>-14 </sup> * 10<sup>0 </sup> = 10 <Sup>-14 </sup>. |
Die Konzentrationen gehen daher von 10<sup>0 </sup> bis 10 <Sup>-14 </sup>. Der pH-Wert geht also von 0 bis 14. Dabei ist 0 am sauersten und 14 am basischsten. | Die Konzentrationen gehen daher von 10<sup>0 </sup> bis 10 <Sup>-14 </sup>. Der pH-Wert geht also von 0 bis 14. Dabei ist 0 am sauersten und 14 am basischsten. | ||
Version vom 18. Juni 2011, 21:46 Uhr
Der pH-Wert ist der negative dekadische Logarithmus der H3O+ Konzentration. Er ist ein Mass für den sauren & basischen Charakter einer Lösung, dabei handelt es sich bloss um wässrige Lösungen, da nur solche in der Natur vorkommen.
pH = - log [H3O+]
Autoprotolyse von Wasser
Autoprotolyse: H2O + H2O ⇌ H3O+ + OH -
Wenn zwei Wassermoleküle in einem bestimmten Winkel aufeinandertreffen entstehen bei dieser Kollision je ein Oxonium- & Hydroxid-Ion. Die Konzentration dieser beider Ionen ist in reinem Wasser gleich (Ionengleichgewicht, welches in jeder basischen/saueren Lösung gilt). Danke diesem Gleichgewicht kann man von der einen Konzentration auf die andere schliessen (im Verhältnis zu H2O ist die Konzentration jedoch sehr gering, da die Reaktion sehr linkslastig ist). Man kann K mit Hilfe der elektr. Leitfähigkeit berechnen. Denn wegen den Ionen die bei der Autoprotolyse entstehen, ist selbst reines Wasser leicht elektr. Leitfähig.
Daraus ergibt sich die Konzentration von H3O+ & OH -, welche in reinem Wasser bei je 10-7 M (=Mol/Liter) liegt.
Mass für den pH-Wert
Mischt man dem Ampholyten Wasser eine Säure oder Base bei, so reagiert Wasser mit der beigegebenen Substanz.
Säure in Wasser: HA + H2O ⇌ A- + H3O+ (Säure + Wasser ⇌ Base +Oxonium-Ion)
Idee: Je mehr H3O+ desto sauerer ist die Lösung.
Base in Wasser: A- + H2O ⇌ HA + OH - (Base + Wasser ⇌ Säure +Hydroxid-Ion)
Idee: Je mehr OH - desto basischer ist die Lösung.
Wegen der Autoprotolyse von Wasser ist destiliertes Wasser nicht ionenfrei. Wird nun eine Säure beigefügt, so steigt die Konzentration von H3O+ während die Konzentration von OH - sinkt. Um den pH-wert zu berechnen verwendet man die H3O+ Konzentration. Die Wasserkonzentration ist eigentlich nicht konstant und hängt davon ab, wieviel Säure/Base Wasser beigefügt wird. Solange man jedoch nicht mehr als 1 Mol Säure/Base hinzugibt, kann man davon ausgehen, dass die Wasserkonzentration konstant ist (da die Ungenauigkeit relativ klein ist). Diese Voraussetzung ist wichtig damit der pH-Wert Gültigkeit hat.
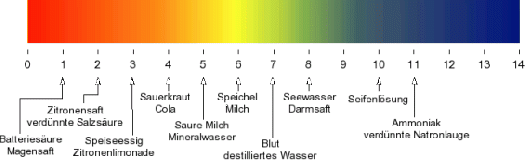
Grenzbereich des pH-Wertes
Da KW = [H3O+] * [OH -] = 10 -14 konstant bleibt, ist die maximal mögliche Konzentration 100 (=1) * 10 -14 = 10 -14 und die minimal mögliche Konzentration 10 -14 * 100 = 10 -14 .
Die Konzentrationen gehen daher von 100 bis 10 -14 . Der pH-Wert geht also von 0 bis 14. Dabei ist 0 am sauersten und 14 am basischsten.
Fügt man die maximale Säuremenge 1 Mol hinzu, so ist die H3O+ Konzentration auch maximal und der pH-Wert somit 1.
Fügt man die maximale Basemenge 1 Mol hinzu, so ist die H3O+ Konzentration minimal und der pH-Wert somit 14.